Détoxication des hydroperoxides
PDFDiverses familles d’enzymes participent à la détoxication des Espèces réactives de l’Oxygène (ERO) et en particulier les hydroperoxydes.
Les superoxyde dismutases (SOD) catalysent la transformation de l’anion superoxyde O2•− en hydroperoxyde H2O2 caractérisées par le métal présent dans leur site actif. Elles ont été identifiées dans les chloroplastes (CuZn-SOD thylacoïdale, Fe-SOD stromatique), dans les mitochondries (Mn-SOD), dans les peroxysomes (CuZn-SOD) et dans le cytosol (CuZn-SOD).
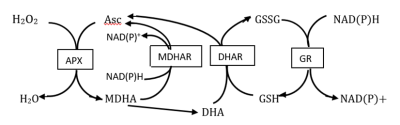
D’autres enzymes qui détoxifient l’hydroperoxyde H2O2 participent à des cycles impliquant ascorbate et glutathion comme le cycle ascorbate-glutathion (CAG) ou les enzymes de type rédoxines.
1. Cycle ascorbate-glutathion (CAG)
Le rôle essentiel de l’ascorbate et du glutathion résulte de leur participation au cycle ascorbate-glutathion (CAG), aussi appelé cycle Halliwell-Asada-Foyer, du nom des scientifiques qui l’ont identifié (Figure 1).
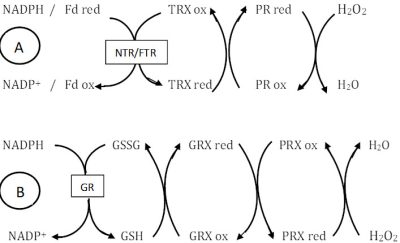
2. Détoxication par des enzymes de type rédoxines
Les rédoxines, thiorédoxines (TRX), glutarédoxines (GRX) et peroxyrédoxines (PRX), que l’on trouve dans les chloroplastes, les mitochondries et le cytosol, jouent un rôle important dans les processus de détoxication. La Figure 2 donne deux exemples de leur fonctionnement, l’un dans le chloroplaste avec l’association TRX/PRX (Figure 2A), l’autre dans le cytosol avec l’association GRX/Glutathion (Figure 2B). Dans le chloroplaste, deux systèmes thiorédoxine (TRX) et peroxyrédoxine (PRX) coexistent, l’un membranaire et impliquant la ferrédoxine du PSI, l’autre stromatique et impliquant le NADPH délivré lors des réactions photochimiques.




