Epigénétique : Comment l’environnement influence nos gènes
PDF
Notre environnement a une influence sur notre génome par des modifications dites épigénétiques. Par exemple, avec des patrimoines génétiques identiques, deux jumeaux peuvent évoluer différemment en fonction de leurs environnements respectifs. Les individus, et par voie de conséquence leurs gènes, sont en effet soumis à de nombreux facteurs environnementaux : alimentation, maladies, médicaments et toxiques, stress, lieu & hygiène de vie, qui peuvent modifier autant leurs cellules que leur ADN. Ainsi dans les paires de jumeaux monozygotes, de grandes différences en ce qui concerne la trajectoire de vie ont été constatées. L’un pouvait développer une obésité et l’autre rester mince ; l’un pouvait être sain d’esprit et l’autre développer une pathologie mentale. Quelques exemples pris chez l’animal et l’homme mettent en évidence le rôle de l’épigénétique [1] dans la transmission de caractères acquis.
1. La méthylation : clé de voûte de l’épigénétique
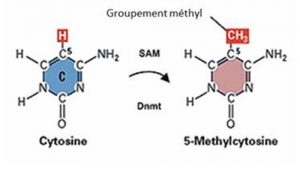
On sait aujourd’hui que les gènes peuvent être « allumés » ou « éteints » par plusieurs types de modifications chimiques qui ne changent pas la séquence de l’ADN comme des méthylations de l’ADN et des modifications des histones, ces protéines sur lesquelles s’enroule l’ADN pour former la chromatine [2]. Toutes ces modifications constituent autant de « marques épigénétiques » [3] regroupées sous le terme d’épigénome (Figures 1 & 2). Les modifications épigénétiques sont induites par l’environnement au sens large : la cellule reçoit en permanence toutes sortes de signaux l’informant sur son environnement, de manière à ce qu’elle se spécialise au cours du développement, ou ajuste son activité à la situation (Lire L’épigénétique, le génome et son environnement). Ces signaux, y compris ceux liés à nos comportements (alimentation, tabagisme, stress…), peuvent conduire à des modifications dans l’expression de nos gènes, sans affecter leur séquence. Le phénomène peut être transitoire, mais il existe des modifications épigénétiques pérennes, qui persistent lorsque le signal qui les a induites disparaît. Contrairement aux mutations génétiques qui sont irréversibles, le « marquage » épigénétique peut changer. Un simple changement d’environnement peut modifier le fonctionnement des gènes dont nous héritons à la naissance, et donc de notre « phénotype » [4].
Par ailleurs, il existe une autre échelle dans les processus épigénétiques puisqu’il existe un ensemble d’éléments régulateurs des processus épigénétiques eux-mêmes.Ce sont soit des structures régulatrices insérées dans la séquence d’ADN parfois à grande distance des gènes, soit des petites molécules mobiles appelées micro ARN (miRNA) ou les petits ARN interférents qui sont impliqués dans de nombreux processus chez les eucaryotes (exemple élimination de la méthylation, assemblage de la chromatine, et répression de la formation des protéines qui sont activés dans les réponses immédiates au stress). Beaucoup plus petits que les ARN messagers, ces miRNA empêchent ces derniers de véhiculer leur message, en les neutralisant ou les détruisant.
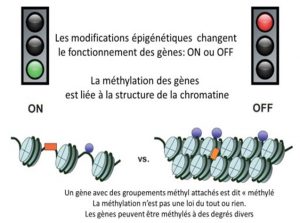
En d’autres termes, si le chromosome est la bande magnétique d’une cassette et que chaque gène correspond à une piste enregistrée sur la bande, les modifications épigénétiques sont des morceaux de ruban adhésif repositionnables qui vont masquer ou démasquer certaines pistes, les rendant illisibles ou lisibles. Au sujet des modifications qui masquent, on parle d’agents méthylants, responsables de la méthylation de l’ADN et des histones (cf plus haut). A l’inverse, d’autres molécules ont pour effet de stimuler l’expression des gènes. Il s’agit des « groupes acétyles» et l’on parle dans ce cas d’agents acétylants et d’acétylation des histones.
2. Quelles conséquences dans le règne animal ?
2.1. Généralités
Certaines marques épigénétiques sont susceptibles de passer à la descendance. La transmission intergénérationnelle de marques matérialisées par la méthylation de l’ADN est très documentée chez les plantes. Chez les mammifères, l’étude du phénomène est beaucoup plus complexe et fait encore l’objet de controverses. Dans ce paragraphe et par le biais de quelques exemples pris chez l’animal (souris Agouti, yeux rouges de la drosophile et les expériences d’adoption croisée chez le rat), nous observons l’épigénétique en tant que domaine étudiant l’influence de l’environnement et de l’histoire individuelle sur l’expression des gènes.
2.2. Modèle de la souris Agouti

Il a fallu attendre la fin du XXe siècle pour découvrir un type de souris qui permet aux scientifiques à mettre en évidence les connexions complexes qui lient l’alimentation à l’épigénétique. Parmi les nombreux gènes qui contribuent à la couleur du pelage chez la souris, l’un d’entre eux se nomme « Agouti ». La version la plus intéressante du gène Agouti est connue sous le nom de « Agouti viable yellow » ou Avy (figure 3). Si le gène Avy présente peu ou pas de méthylation, il est alors actif dans toutes les cellules, et les souris sont jaunes. Ces souris jaunes présentent une susceptibilité à l’apparition de pathologies comme l’obésité, le diabète ou certains cancers. Mais si Avy est hyperméthylé, son expression « s’éteint », ce qui implique que la souris présente une couleur brune, et n’a aucun problème de santé, même si elle possède exactement le même gène Agouti que les souris jaunes. Entre ces deux extrêmes, Avy peut être méthylé à différents degrés, ce qui affecte le niveau d’activité du gène [5]. Il en résulte un beau dégradé de souris tachetées, chez lesquelles l’activité du gène Avy diffère même d’une cellule à une autre. Une même portée génétiquement identique varie en couleur selon ce spectre, en raison de variations épigénétiques établies dans l’utérus. De plus, indépendamment de la couleur du pelage, cela met en évidence les effets du régime alimentaire sur la méthylation.
Randy Jirtle, un chercheur américain a réussi une expérience remarquable avec ces souris porteuses du gène Agouti. En les nourrissant avec des vitamines B, il n’a pas « soigné » ces souris génétiquement malades, mais l’effet bénéfique s’est manifesté sur la descendance [6]. En d’autres termes, les descendants de souris porteuses du gène Agouti nourries avec des vitamines B ne sont plus malades ni même beiges (le gène Agouti est toujours là, mais il n’est plus exprimé), alors que les descendants de celles qui n’ont pas reçu de vitamines B restent malades de génération en génération !
2.3. Les drosophiles et les yeux rouges

Les drosophiles sont des insectes communément utilisés au laboratoire. Leur génome est relativement simple à comprendre et du coup, elles sont les « stars » de la recherche génétique…En avril 2009, le Dr Renato Paro, de l’Université de Bâle, a annoncé une nouvelle découverte formidable les concernant : si un œuf de drosophile est chauffé à 37° degrés avant éclosion, la mouche a les yeux rouges. Sinon, elle a les yeux blancs…. Mieux ! Le caractère « yeux rouges » est passé de génération en génération. Il s’agit donc d’une caractéristique acquise par l’influence d’un facteur externe (la température) qui devient héréditaire [7].
Ces études chez l’animal, comme les études suivantes, semblent soutenir la théorie scientifique que représente le Lamarckisme. Selon sa célèbre publication – l’« Influence des circonstances » – publiée en 1809-1810 [8], Lamarck soutient l’idée que des changements physiques acquis au cours de la vie d’un individu pourraient être transmis à sa descendance [9]. Cependant chez l’homme nous n’avons pas de preuve de la persistance de ces effets épigénétiques au-delà de quelques générations. Ces résultats ne remettent donc pas réellement en cause la conception Darwinienne de l’évolution à long terme des espèces par l’action de la sélection naturelle sur les variations héréditaires fortuites. (lire Théorie de l’évolution : incompréhensions et résistances & Adaptation : répondre aux défis de l’environnement).
2.4. Le maternage chez la souris : au-delà de l’utérus
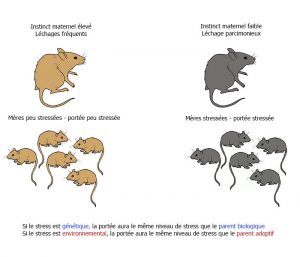
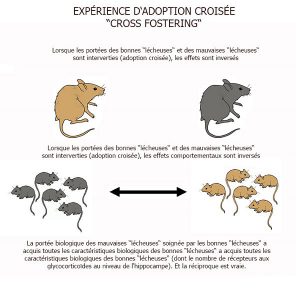
De simples caresses auraient-elles aussi le pouvoir d’influencer les gènes ? Chez le rat, le léchage remplit la même fonction que la caresse chez l’humain. Or des études montrent que les bébés rats souvent léchés par leur mère sont plus calmes. Mais à l’Université Mc Gill de Montréal, l’équipe du Pr Michael Meaney (Canada) est allée beaucoup plus loin en révélant des empreintes de ces soins maternels jusque dans cerveau des jeunes rats, au niveau de l’hippocampe [10].
En fait c’est bien le « léchage » qui influence l’activité d’un gène prémunissant les rats contre le stress. Ce gène, appelé NRC31, produit une protéine (récepteur aux glucocorticoïdes GC) qui contribue à diminuer la concentration d’hormones de stress (cortisol) dans l’organisme [11]. Il faut cependant activer une portion bien précise de ce gène, grâce à l’interrupteur épigénétique que représente la méthylation de l’ADN. L’analyse des cerveaux de rats qui n’ont pas reçu assez d’affection par léchage l’a démontré : l’interrupteur lié au gène NRC31 (gène codant pour le récepteur aux glucocorticoïdes) était défectueux (gène ayant subi la méthylation, donc inactif) dans les neurones de l’hippocampe des rats (zone au niveau cérébral qui intègre les stress ambiants). En conséquence, la quantité d’hormones du stress (cortisol) augmente au niveau du sang et donc, même en l’absence d’éléments perturbateurs, ils vivent dans un état de stress constant.
3. Impact de l’alimentation sur nos gènes

Afin de montrer le lien entre épigénétique et régime alimentaire, notamment chez l’homme, il faut remonter à l’histoire de la « famine hollandaise de 1944 » (dutch hunger famine). Elle offre en effet aux scientifiques une sorte de laboratoire grandeur nature pour tester ces hypothèses. Pendant l’hiver 1944-1945, l’ouest des Pays-Bas a été affamé suite à un blocus décrété par l’Allemagne nazie [12].
Les études ont montré que les enfants de femmes enceintes exposées à cette famine étaient atteints de pathologies telles que le diabète, l’obésité, des maladies cardiovasculaires, la microalbuminurie (albumine dans les urines), etc. Par ailleurs, ils étaient plus petits que la normale. Devenus adultes, ils on ensuite eu eux aussi des enfants plus petits que la moyenne ! [13].
Ces données suggèrent que la famine vécue par les mères avait provoqué des modifications épigénétiques transmise aux générations suivantes. Leur patrimoine génétique avait gardé la trace de cet événement; de quoi accréditer la théorie selon laquelle la santé d’un individu est en partie programmée par l’environnement auquel le fœtus est exposé dans l’utérus. Nous savons aujourd’hui que ces effets sur la taille proviennent de changements au niveau de marqueurs épigénétiques présents sur leur ADN, liés aux carences en certaines molécules cruciales dans l’alimentation des grand-mères hollandaises de cette période. En effet, afin de maintenir fidèlement un bon niveau de méthylation au cours des divisions cellulaires, de nouveaux groupements méthyl doivent être ajoutés sur l’ADN nouvellement copié. Or cet apport constant en groupements méthyl provient directement de notre nourriture à partir d’acides aminés et de vitamines (ex méthionine, bétaïne ou choline). Par ailleurs, nous pouvons aussi fabriquer des groupements « méthyl » à partir de précurseurs chimiques comme l’acide folique.
Mais en 2008, des chercheurs ont encore plus clairement élucidé ces modifications épigénétiques [14] : les individus ayant vécu connu la famine in utero ont moins de groupes méthyles attachés au gène qui commande la fabrication d’un facteur de croissance, l’IGF-2 (insulin-likegrowth factor-2). D’autres éléments chimiques provenant de notre nourriture sont également nécessaires pour transporter des groupements méthyles à travers le corps et pour les attacher soigneusement à l’ADN : zinc, vitamine B12…
4. Quelles leçons en tirer ?
Alors que le génome est très figé, l’épigénome est bien plus dynamique. Les modifications épigénétiques permettraient aux individus d’explorer rapidement une adaptation à une modification de l’environnement, sans pour autant « graver » ce changement adaptatif dans le génome. Les enjeux de l’épigénétique concernent non seulement la médecine et la santé publique (Lire L’épigénétique, le génome et son environnement) mais aussi les théories sur l’évolution (lire Théorie de l’évolution : incompréhensions et résistances). En effet, elle jette le soupçon sur l’environnement qui pourrait moduler l’activité de certains de nos gènes pour modifier nos caractères, voire induire certaines maladies potentiellement transmissibles à la descendance. A l’évidence la famine hollandaise de l’hiver 1944-1945 démontre que des changements permanents se sont produits dans le patrimoine génétique des femmes alors enceintes, ensuite transmis de génération en génération. Cela signifierait que les traumatismes touchent également les cellules germinales (spermatozoïdes et ovules), seul lien biologique entre les générations.
Il est désormais largement admis que des anomalies épigénétiques contribuent au développement et à la progression de maladies humaines, en particulier de cancers. Les processus épigénétiques interviennent en effet dans la régulation de nombreux évènements tels que la division cellulaire, la différenciation (spécialisation des cellules dans un rôle particulier), la survie, la mobilité… L’altération de ces mécanismes favorisant la transformation des cellules saines en cellules cancéreuses, toute aberration épigénétique peut être impliquée dans la cancérogenèse. Des anomalies épigénétiques activant des oncogènes (gènes dont la surexpression favorise la cancérogenèse) ou inhibant des gènes suppresseurs de tumeurs ont pu être mises en évidence. De même, des mutations affectant des gènes codant pour les enzymes responsables des marquages épigénétiques ont été identifiées dans des cellules tumorales. Reste à savoir si ces phénomènes sont la cause ou la conséquence du développement de cancer. Il semble néanmoins qu’ils participent à la progression tumorale (évolution du cancer).
Par ailleurs, le rôle de l’épigénétique est soupçonné et très étudié dans le développement et la progression de maladies complexes et multifactorielles, comme les maladies neurodégénératives (Alzheimer, Parkinson, sclérose latérale amyotrophique, Huntington…) ou métaboliques (obésité, diabète de type 2…). De la même manière que l’on sait aujourd’hui obtenir la séquence d’un génome complet, il est aussi possible de connaître l’ensemble des modifications épigénétiques qui le caractérise : on parle d’épigénome. C’est ce type d’approche globale et non biaisée qui permettra de mieux appréhender l’implication de l’épigénétique dans les maladies humaines…
Et les télomérases ?
En marge des processus épigénétiques abordés il y a plus de 50 ans par le biologiste britannique Conrad Waddington (1905-1975) [15] et mentionnés plus haut, il faut citer un phénomène d’une importance cruciale, et sensible à notre environnement. Il s’agit d’une découverte majeure en biologie moléculaire qui a valu le prix Nobel de médecine à Elizabeth Blackburn et Carol Greider : l’identification par ces chercheurs d’une enzyme appelée la télomérase. Cette enzyme régule la longueur des télomères, qui sont des segments répétés d’ADN non codant, situés à l’extrémité de chaque chromosome (cf focus). On peut figurer ces télomères comme les petits bouts de plastique qui protègent les embouts de vos lacets et qu’on appelle « aglets ». Ces télomères forment des petits capuchons aux extrémités des chromosomes, empêchant le matériel génétique de « s’effilocher ». Ce sont, entre autres, les aglets du vieillissement et ils ont tendance à raccourcir avec le temps. Ainsi sous l’influence de la télomérase, les télomères peuvent cesser de se raccourcir, et même s’allonger. Le vieillissement est donc un processus dynamique qui peut être accéléré ou ralenti. Les travaux d’Elizabeth Blackburn et du médecin nutritionniste Dean Ornish ont clairement montré les effets des changements des modes vie sur l’allongement de ces télomères (voir focus Ralentir le vieillissement : la piste de la télomérase ?) [16].
En conclusion l’importance du rôle de l’environnement dans l’hérédité épigénétique est loin d’être résolue, malgré les effets d’annonce qui ont conduit à un regain d’intérêt pour la thèse de Lamarck de » l’héritabilité des caractères acquis » (voir Lamarck et Darwin : deux visions divergentes du monde vivant). L’interrogation ultime est celle de l’importance des processus épigénétiques dans l’Évolution. La communauté scientifique reste très partagée et une question centrale demeure: les états épigénétiques sont-ils transmis sur un nombre suffisant de générations pour donner prise à la sélection naturelle ? « . Les médecins et les sociologues en posent une autre, qui nous intéresse à court et moyen terme : « Notre mode de vie compte t-il plus que notre hérédité ? » (Lire Focus Le concept de l’horloge épigénétique et ses enjeux économiques).
Références et notes
Photo de couverture : Ces jumelles ont le même génotype, mais leur épigénotype et leur phénotype sont différents car elles n’ont pas vécu exactement dans le même environnement. [source: Peter Voerman photography via Visual Hunt / CC BY-NC]
[1] Épigénétique : Ensemble des changements d’activité des gènes qui sont transmis au fil des divisions cellulaires ou au fil des générations sans faire appel à des mutations de l’ADN. Cette « mémoire de l’activité des gènes » se fonde sur des états chromatiniens, ou « marques épigénétiques ».
[2] Chromatine Substance de base des chromosomes constituée de la molécule d’ADN associée à des protéines nommées « histones », autour desquelles elle s’enroule.
[3] Marques épigénétiques Modifications chimiques de l’ADN ou des protéines qui lui sont associées dans la chromatine. Ces modifications (ex méthylation des cytosine ou C) participent au contrôle de l’activité des gènes sans affecter la séquence des nucléotides, les « lettres » (A, T, C ou G) qui écrivent le message des gènes sur l’ADN.
[4] Jablonka E & Lamb M (2005) Evolution in four dimensions. Cambridge MA. MIT press
[5] Morgan HD et al. (1999) Epigenetic Inheritance at the agouti locus in the mouse. Nature genetics 23: 314-318
[6] Jirtle, RL & Tyson, FL, eds. (2013) Environmental Epigenomics in Health and Disease: Epigenetics and Complex Diseases Origins, Heidelberg: Springer
[7] Merdes G & R Paro (2009) About Combs, Notches, and Tumors: Epigenetics Meets Signaling. Developmental Cell 17: 440-442
[8] Lamarck JB (1809-1810) Influence des circonstances sur les actions des animaux (5e leçon), Muséum National d’Histoire Naturelle de Paris
[9] L’évolution selon Charles Darwin (1809-1882) : Les espèces évoluent à la suite de « variations » (changements de caractères) qui se produisent de façon aléatoire, et qui sont transmises aux descendants. Seules les variations avantageuses (« adaptatives ») sont sélectionnées par l’environnement : c’est la « sélection naturelle ». L’évolution selon Jean-Baptiste de Lamarck (1744-1829) : L’environnement dicterait un changement bénéfique pour l’individu, qui serait transmis à sa descendance. Cette « hérédité des caractères acquis » gouvernerait l’évolution des espèces.
[10] Francis D et al. (1999) Nongenomic transmission across generations of Maternal behavior and stress in the rat. Science 1155-1158
[11] Weaver IC et al. (2004) Epigenetic programming by maternal behavior. Nature Neuroscience 7: 847-854
[12] Lumey LH et al. (2007) Cohort profile: The dutch Hunger Winter Families Study. Int J Epidemiol. 36: 1196-1204
[13] Stein AD et al. (2004) Intrauterine famine exposure and body proportions at birth: the Dutch Hunger Winter. Int J Epidemiol 33: 831-836
[14] Heijmans BT et al. (2008) Persistent epigenetic differences associated with prenatal exposure to famine in humans. PNAS 17046-17049
[15] Baedke J (2013) The epigenetic landscape in the course of time: Conrad Hal Waddington’s methodological impact on the life sciences. Studies in History and Philosophy of Science Part C: Studies in History and Philosophy of Biological and Biomedical Sciences 44 : 4 Part B 756-773
[16] Ornish D et al. (2008) Increased telomerase activity and comprehensive lifestyle changes: a pilot study. Lancet Oncol. 2008 9(11):1048-57
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : DROUET Emmanuel (19 mai 2021), Epigénétique : Comment l’environnement influence nos gènes, Encyclopédie de l’Environnement. Consulté le 24 avril 2024 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/sante/epigenome-facteurs-environnementaux/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.







