Virus des océans
PDFLucie Bittner, maître de conférences en bioinformatique et génomique évolutive à Sorbonne Université, Paris
Chris Bowler, Directeur de recherche CNRS, Institut de Biologie de l’École Normale Supérieure, École Normale Supérieure, Paris
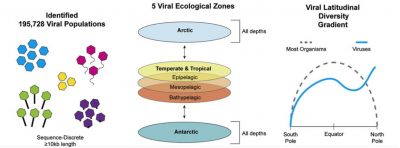
L’expédition Tara Oceans a permis la première étude à grande échelle des virus dans l’environnement marin. Le séquençage de 43 échantillons correspondant à 26 stations a permis d’étudier la diversité et la structure des communautés virales entre 6 provinces océaniques (i.e. mer Méditerranée, mer Rouge, ouest de l’Océan Indien, sud de l’Océan Atlantique, Océan Austral, sud de l’Océan Pacifique) [3].
L’assemblage métagénomique de 145 viromes marins a mis en évidence 195 728 populations virales (Figure 1) [4]. Les virus ne possédant pas de gènes ribosomaux permettant leur classification en taxonomie, c’est donc l’étude de protéines virales qui a permis de détecter et de définir :
- Un ensemble des groupes communs à tous les échantillons ou groupe cœur ;
- L’union de l’ensemble des groupes détectés, correspondant à 1,3 million de groupes (appelé pan-virome).
Les données métagénomiques et morphologiques révèlent des schémas biogéographiques dans lesquels les communautés virales sont transportées passivement par les courants océaniques, et structurée localement par les conditions environnementales (Figure 1) :
- Les communautés virales de l’océan mondial peuvent être séparées en cinq zones écologiques distinctes, y compris deux régions arctiques distinctes;
- Macrodiversité (diversité inter-population) et microdiversité (diversité intra-population) virales ne suivent pas la variation latitudinale de la diversité.
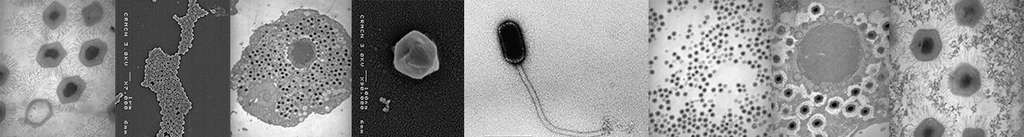
Des données morphologiques quantitatives obtenues par microscopie électronique à transmission complètent ces observations (Figure 2).
Les virus infectent d’autres organismes et s’y multiplient en utilisant les voies métaboliques intracellulaires et les machineries de synthèse des protéines de l’hôte. Dans les océans, ils jouent un rôle important dans l’écologie du plancton [4] en induisant :
- la mortalité ;
- le transfert horizontal de gènes [5] ;
- la modulation du métabolisme des communautés microbiennes.
Les virus ciblent divers hôtes tant procaryotes, comme la cyanobactérie Synechococcus, qu’eucaryotes comme le protiste Emiliania huxleyi. Ils jouent un rôle important dans l’évolution de leurs hôtes [6].
Cette nouvelle compréhension des virus océaniques est essentielle pour une intégration plus large dans les modèles écosystémiques. Ainsi, les virus joueraient un rôle primordial de “régulateurs” des populations planctoniques mais aussi des flux de matière. Par exemple en lysant les organismes phytoplanctoniques qui fixent le carbone ambiant via la photosynthèse, les virus contribueraient au flux de carbone des couches supérieures de l’océan vers les profondeurs, voire dans les sédiments (Lire : Focus La pompe à carbone biologique de l’océan).
Notes et références
[1] Les virus géants ont été découverts au début du siècle dans des environnements très divers. Ils ont été appelés ainsi parce qu’ils sont plus grands que les autres virus aussi bien en taille des particules que de longueur du génome. Ces virus géants, tels que les mimivirus, les pandoravirus et les virus de la méduse isolés dans les tours de refroidissement, les étangs, les sources chaudes et l’Océan, ajoutent de nouveaux mystères à l’origine et à l’évolution de la vie.
[2] Breitbart M., 2012, Marine viruses: truth or dare. Annu Rev Mar Sci. 4:425-448; Fischer M.G. et al., 2010, Giant virus with a remarkable complement of genes infects marine zooplankton. Proc. Natl. Acad. Sci. USA, 107:19508-19513.
[3] Gregory A.C. et al. (2019). Marine DNA viral macro- and microdiversity from Pole to Pole. Cell. 177(5):1109-1123.e14. doi: 10.1016/j.cell.2019.03.040.
[4] Fuhrman J. A., 1999, Marine viruses and their biogeochemical and ecological effects. Nature, 399:541-48; Weitz J.S. & Wilhelm S.W., 2012, Ocean viruses and their effects on microbial communities and biogeochemical cycles », F1000 Biology Reports, 4(17).
[5] Ignacio-Espinoza J.C. & Sullivan M.B., 2012, Phylogenomics of T4 cyanophages: lateral gene transfer in the ‘core’ and origins of host genes ». Environ Microbiol., 14(8): 2113-2126.
[6] Koskella B. & Brockhurst M.A., 2014, Bacteria–phage coevolution as a driver of ecological and evolutionary processes in microbial communities ». Fems Microbiology Reviews, 38(5):916-931; Frada M., et al., 2008, The « Cheshire Cat » escape strategy of the coccolithophore Emiliania huxleyi in response to viral infection. Proc. Natl. Acad. Sci. USA, 105(41):15944-15949.




