Comment les extinctions de vertébrés menacent les forêts tropicales
PDF
La plupart des arbres tropicaux produisent des fruits charnus mangés par des vertébrés (dits frugivores) qui dispersent les graines des plantes. La régénération des forêts tropicales dépend donc des populations de frugivores, qui sont en forte diminution, ou même éteintes dans de nombreuses régions du globe. C’est le cas de l’emblématique dodo disparu de l’île Maurice peu après sa colonisation par l’Homme, comme de la plupart des vertébrés frugivores de l’archipel des Mascareignes. Ces îles volcaniques de l’océan Indien constituent un modèle unique pour étudier les conséquences de la disparition des vertébrés sur la dynamique forestière. En effet, l’historique des extinctions de vertébrés y est très bien documenté, et l’analyse des compositions floristiques des coulées de lave d’âges différents permet de reconstituer la dynamique de leur recolonisation par les plantes, et de mettre en évidence l’impact des extinctions des vertébrés frugivores sur le fonctionnement des forêts tropicales.
1. Pourquoi étudier les conséquences des extinctions dans les Mascareignes ?
1.1. L’importance de la frugivorie dans le fonctionnement des forêts
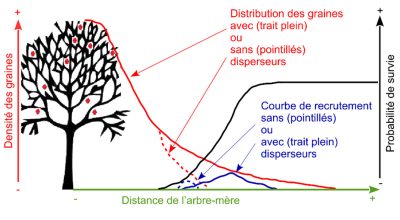
Parmi les interactions plantes-animaux, les interactions entre les vertébrés frugivores et les plantes à fruits charnus sont longtemps restées peu étudiées, en comparaison avec l’herbivorie ou la pollinisation. Il faut en effet attendre les travaux de Janzen et Connell pour que l’influence cruciale de la dispersion sur la dynamique des populationsEnsemble des individus d’une même espèce et pouvant se reproduire entre eux dans un territoire donné et des communautésEnsemble d’espèces appartenant à un même groupe taxonomique ou fonctionnel en interaction au sein d’un écosystème (par exemple la communauté des plantes ligneuses) de plantes soit reconnue (Figure 1) [1].
De nombreux écosystèmes sont largement dominés par les plantes à fruits charnus. Elles représentent par exemple entre 75 % et 90 % des plantes ligneusesPlantes produisant du bois (ou des tissus durs riches en lignine chez les palmiers par exemple) dans les forêts tropicales humides d’Afrique centrale, de Papouasie ou du Costa Rica [2] et entre 54 % et 90 % des forêts tropicales insulaires [3]. Si l’on considère une définition plus large de la frugivorie en intégrant certaines plantes à fruits secs, les forêts tempérées elles-mêmes comptent entre 25 et 55 % de plantes adaptées à une dispersion après ingestion par des vertébrés [2]. La frugivorie joue donc un rôle central dans le fonctionnement d’une grande partie des écosystèmes planétaires.
Jusqu’aux années 1990, la frugivorie était surtout étudiée en tant que processus co-évolutif d’interaction entre deux espèces. Avec l’accélération de la perte de biodiversité et la défaunationExtinction locale ou globale des populations ou des espèces d’animaux sauvages. Cette extinction peut être fonctionnelle (l’espèce existe encore mais ne joue plus de rôle dans son écosystème) généralisée, la question de la conservation des forêts tropicales est devenue centrale. En effet, chercher à préserver une forêt dominée par des arbres à fruits charnus pourrait s’avérer totalement inefficace en l’absence des frugivores disperseurs (Figure 1). Pire, l’effondrement des vertébrés pourrait compromettre la capacité même des écosystèmes à se reconstruire à une époque où la destruction des écosystèmes tropicaux se poursuit à large échelle et où le réchauffement climatique rend cruciale la mobilité des plantes [4]. L’effondrement global des populations de vertébrés que nous vivons actuellement pose donc d’inquiétantes questions concernant la résilienceCapacité à maintenir ou rétablir son fonctionnement face à une perturbation de ces écosystèmes. Cela d’autant plus que les vertébrés de grande taille, qui sont les plus à même de disperser efficacement une multitude d’espèces ligneuses, disparaissent en premier [5],[6].
1.2. L’intérêt des Mascareignes comme système d’études
- Les Mascareignes sont dépourvues de mammifères terrestres, mais aussi de formes d’oiseaux continentales comme les calaos qui sont souvent d’importants frugivores dans les forêts tropicales de l’Ancien Monde ;
- Ces absences offrent des niches vacantes qui sont occupées par des reptiles (tortues géantes terrestres et scinques), des chauve-souris (roussettes) et surtout des lignagesEnsemble des descendants d’un ancêtre commun d’oiseaux divers : bulbuls [9] (Figure 3), huppes, pigeons, perroquets, râles, oiseaux-lunettes ;
- Parmi les oiseaux, la famille des colombidés joue dans les Mascareignes un rôle particulièrement important et compte diverses espèces de founingos [10] et de dodos. Ces derniers oiseaux qui ont perdu la capacité de voler n’ont probablement jamais existé à La Réunion du fait de la relative jeunesse géologique de l’île.

Parce qu’il existe une forte corrélation entre la taille des populations de frugivores et l’efficacité de la dispersion [12], il est vraisemblable que les espèces de plantes qui étaient consommées par cette faune hyper-abondante bénéficiaient d’une dispersion très efficace. L‘effondrement faunistique qui suit le début de la colonisation humaine au 17e siècle a probablement eu, et a encore, des conséquences délétères sur la régénération de nombreuses espèces de plantes à fruits charnus.

Les Mascareignes présentent enfin une remarquable diversité végétale malgré leur relatif éloignement des sources continentales. La flore de l’archipel est aujourd’hui bien connue des points de vue taxonomique et fonctionnel en comparaison avec les grandes forêts continentales. Ces éléments, combinés à la bonne connaissance de la faune d’origine de l’archipel et de sa cinétique d’extinction, contribuent à en faire un remarquable système d’étude des conséquences sur le long terme de la rupture d’interactions de frugivorie.
2. Des extinctions fulgurantes depuis la colonisation humaine
2.1. Un terrible bilan dans les Mascareignes, comme dans les îles océaniquesÎles dont le socle rocheux est lié à l’activité volcanique ou corallienne (en milieu tropical uniquement)
L’effondrement des populations de vertébrés est aujourd’hui global [15], mais les îles ont connu un effondrement faunistique majeur avec la colonisation humaine. La plus grande vague d’extinctions connues chez les vertébrés depuis 20 000 ans a ainsi eu lieu chez les oiseaux du Pacifique où l’on estime qu’environ 2000 espèces ont disparu suite à la colonisation humaine [16]. Il s’agissait surtout d’oiseaux terrestres (râles, pigeons, perroquets et passereaux), parmi lesquels figuraient de nombreuses espèces frugivores. Ces oiseaux insulaires ont principalement disparu pour les raisons suivantes :
- La destruction et la fragmentation des habitats indigènes ;
- La chasse ;
- L’introduction de vertébrés terrestres, des mammifères essentiellement (rats, chats, chiens et cochons en tête) qui ont rapidement décimé ces espèces dépourvues de comportement de fuite ou de protection face aux prédateurs.

Dans les Mascareignes, les témoignages des premiers explorateurs (Figure 5) et le registre subfossile nous permettent de connaître de manière relativement précise l’historique de la défaunation des frugivores [8],[11]. Le plus grand scinque du monde s’éteint probablement à Maurice avant le 15e siècle, le dodo dès le 17e siècle et le solitaire de Rodrigues au 18e siècle. Les tortues géantes, la rougette, les huppes, les founingos et l’ensemble des perroquets hormis la perruche verte, qui voient souvent leurs populations très réduites dès la fin du 18e siècle, sont tous éteints dans la seconde moitié du 19e siècle.
Aujourd’hui, seuls subsistent de la faune de frugivores d’origine la roussette noire, la perruche verte et le scinque de Telfair (à Maurice uniquement), la roussette de Rodrigues, ainsi que les bulbuls et oiseaux-lunettes. La fulgurance des extinctions apparaît troublante, en particulier à La Réunion où les populations de l’ensemble des grands frugivores s’effondrent en 70 ans après l’installation de l’Homme et s’éteignent en moins de deux siècles de colonisation humaine permanente. Bory de Saint Vincent qui, lors de son passage en 1801, arpente largement La Réunion note qu’il existe encore des forêts majestueuses dans le Sud-Est de l’île, mais que la grande faune en est totalement absente.
2.2. Des forêts sans frugivores et des frugivores sans forêts : comprendre le paradoxe Réunion / Maurice
Dans les Mascareignes, les extinctions présentent d’étonnantes disparités entre les îles et entre les lignages de vertébrés forestiers partagés par les deux principales îles de l’archipel : le bilan des extinctions est plus sévère à La Réunion où subsiste plus d’un tiers des habitats indigènes en comparaison avec Maurice où plus de 95% de ceux-ci ont été transformés [8].
Pour comprendre ce paradoxe, la chronologie des extinctions et les principaux facteurs impliqués depuis le début de la colonisation humaine ont été étudiés [18] :
- Le nombre d’introductions de vertébrés exotiques, en considérant en particulier les prédateurs connus pour leur impact dévastateur en milieu insulaire. Maurice présente non seulement des introductions plus précoces de mammifères prédateurs (Rattus), mais aussi en plus grand nombre avec -par exemple- les macaques et les mangoustes qui n’ont jamais été introduits à La Réunion. Ces multiples introductions ont néanmoins épargné certains îlots au Nord de Maurice qui sont devenus d’importants sanctuaires pour diverses espèces de reptiles.
- La surchasse, en lien avec les changements dans la démographie humaine. Les colons des deux îles étaient d’invétérés chasseurs, et même si La Réunion a subi une surchasse plus précoce que Maurice, l’explosion de la population humaine à Maurice dès la fin du 18e siècle n’a pas mené pour autant à l’extinction totale de sa grande faune indigène.
Ces deux facteurs ne peuvent donc expliquer à eux seuls le paradoxe observé.
- La transformation des habitats, en considérant les caractéristiques altitudinales des habitats relictuels et les implications fonctionnelles sous-jacentes.

3. Les conséquences de la perte des frugivores sur la régénération des forêts
3.1. De riches forêts indigènes incapables de se reconstruire
Comprendre comment la rupture des interactions entre les plantes à fruits charnus et les animaux frugivores peut altérer la diversité et la dynamique des communautés de plantes sur le long terme demeure un défi. En raison de la durée de vie généralement importante des plantes ligneuses à fruits charnus, de telles études doivent en effet s’inscrire dans une temporalité longue.
La chronoséquence de plus de six siècles des coulées de lave du Piton de la Fournaise nous permet de comparer les changements dans la richesse et la composition de différentes guildesEnsembles d’espèces appartenant à un même groupe fonctionnel au sein d’une communauté de plantes établies avant et après la colonisation humaine de La Réunion en 1665 (Figure 8) [19]. En forêt tropicale humide de basse altitude :
- 151 relevés floristiques sont analysés sur 28 coulées de lave datées entre 1401 et 1956, et sur des substrats plus anciens (> 1000 ans). Ces relevés sont classés dans 5 classes d’âge de substrat utilisées comme proxy de la disponibilité en frugivores indigènes :
- Les relevés sur des “vieux substrats” (avec du sol) et sur des coulées datées entre 1401 et 1665 quand les frugivores sont abondants et diversifiés avant la colonisation humaine permanente ;
- Les relevés sur les coulées de 1665 à 1800, quand les populations des grands frugivores sont fortement réduites ;
- Les relevés sur les coulées de1800 à 1900, quand les grands frugivores sont éteints et les petits frugivores encore abondants ;
- Les relevés sur les coulées de 1900 à 1956, quand les populations de petits frugivores ont également décliné ;
- Les modes de dispersion de 146 espèces ligneuses indigènes sont caractérisés : anémochoresplantes dispersées par le vent, autres plantes à fruits secs, plantes à petits fruits charnus et plantes à gros fruits charnus, les fruits de ces dernières ne pouvant être théoriquement dispersés par les petits frugivores.

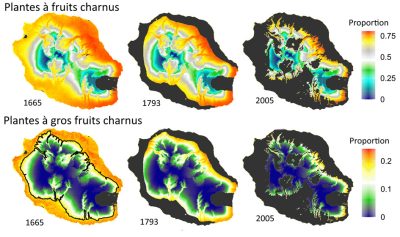
- Les communautés installées avant la colonisation humaine présentent une grande richesse spécifique et une composition comparable. Elles sont largement dominées par les espèces à fruits charnus et riches en plantes à gros fruits charnus (voir aussi Figure 7).
- Dans les communautés installées peu après le début de la colonisation humaine, la diversité décline très fortement, notamment chez les plantes à gros fruits charnus. Ces dernières disparaissent quasiment sur les coulées postérieures à 1800 malgré des conditions souvent favorables (Figure 9).
- La richesse des plantes à petits fruits charnus diminue moins vite que les plantes à gros fruits, avec des niveaux moyens sur les coulées du 17e au 19e siècle, puis faibles sur celles du 20e siècle. En fait, la fragmentation des forêts par les coulées de lave (Figure 4) conduit à un isolement des relevés avec un impact très négatif sur la richesse de cette guilde (Figure 8). Cet effet est surtout visible sur les coulées historiques, montrant que la perte des grands frugivores a gravement altéré la capacité de dispersion à longue distance des plantes à petits fruits.
- En revanche, la richesse des plantes anémochores reste stable tout le long de la chronoséquence en raison d’une barrière à la dispersion beaucoup moins forte.

Enfin, un enseignement important de cette étude concerne les réserves autour de l’emploi des chronoséquences pour étudier la succession écologique [14]. Car ce qui a longtemps été interprété comme des stades typiques de développement des forêts à la Réunion n’est en fait qu’une signature de leur capacité à se reconstruire à une date donnée. Les forêts qui ont 200 ans ne ressembleront pas dans deux siècles à celles qui en ont 400 aujourd’hui, ne serait-ce que parce que les plantes les plus emblématiques des forêts anciennes ne peuvent les atteindre. Cela est d’autant plus inquiétant que d’autres perturbations de la dynamique forestière sont à l’œuvre, avec par exemple les coulées de lave récentes qui sont aujourd’hui largement occupées par des plantes envahissantes n’ayant aucun mal à se disperser.
3.2. La diversité des plantes indigènes en sursis dans les forêts anciennes
On sait depuis la fin des années 2000, que la perte accélérée des frugivores modifie profondément la régénération des forêts tropicales anciennes en milieu continental y compris lorsqu’elles bénéficient de statut de protection [1],[20],[21]. Si l’archipel des Mascareignes a perdu tous ses plus grands frugivores depuis la colonisation humaine, l’île Maurice conserve une importante population de roussettes (masse corporelle moyenne = 450 g) et de perroquets, tandis que La Réunion présente un bulbul indigène (55 g) comme principal frugivore relictuel (Figure 10) [22]. Cette disparité intra-archipel offre ainsi l’opportunité de comparer la régénération des deux forêts de basse altitude les mieux préservées : Mare Longue à La Réunion et Brise Fer à l’île Maurice (Figure 11).
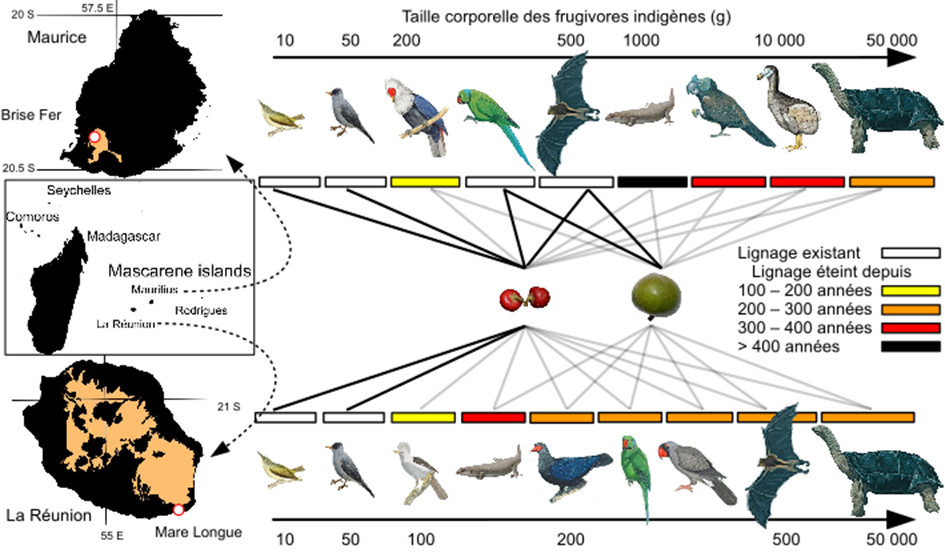

La comparaison des deux sites forestiers de basse altitude les mieux préservés des Mascareignes montre un bien meilleur recrutement des plantes à fruits charnus à Brise Fer à l’île Maurice par rapport à Mare Longue à la Réunion. Ce résultat est d’autant plus marquant que la richesse spécifique est moitié moindre à Mare Longue (50 espèces) par rapport à Brise Fer (100 espèces). Néanmoins, les plantes à fruits charnus à grosses graines se régénèrent mal aux deux sites. Ces résultats suggèrent que :
- Le bulbul de la Réunion, plus gros frugivore encore présent dans cette île, ne disperse pas efficacement la plupart des grands arbres de la canopée malgré un rôle encore important pour diverses plantes à petits fruits.
- Inversement, les grands vertébrés frugivores encore présents à Brise Fer permettent un recrutement massif de nombreuses plantes, mais ne semblent pas disperser efficacement les plantes à grosses graines dont ils se nourrissent pourtant.
Il existe d’autres limitations du recrutement, comme la prédation des graines par les rats ou le broutage des plantules et jeunes arbres par des mammifères introduits (cerf de Java, macaque crabier), qui nécessitent de nouvelles études pour démêler ces résultats. Mais ces limitations agissent probablement secondairement en comparaison de la limitation de la dispersion.
La perte de diversité observée dans les cohortes juvéniles pourrait conduire à long terme à un appauvrissement important de la canopée à Mare Longue et à une forte modification de la composition de la canopée à Brise Fer.
Enfin, ces résultats montrent qu’à Brise Fer où l’invasion par le goyavier (Psidium cattleianum) a été contrôlée dans les années 1990, la forêt conserve une certaine résilience grâce au maintien de la grande faune de frugivores. A l’inverse, la forêt non-envahie de Mare Longue, souvent considérée comme l’un des plus beaux témoignages de forêt tropicale humide de l’archipel, continuera à perdre inexorablement en diversité si la dispersion n’est pas rétablie par semis direct ou ré-ensauvagement (voir Focus Que faire pour restaurer la dispersion ?).

4. Messages à retenir
- Les vertébrés frugivores jouent un rôle crucial dans les forêts tropicales qui sont largement dominées par les plantes à fruits charnus. La disparition des vertébrés pose donc d’inquiétantes questions quant à l’avenir de ces écosystèmes.
- L’archipel des Mascareignes est un système d’études remarquable du fait de la bonne connaissance de l’historique des extinctions et de sa riche flore insulaire.
- La Réunion a perdu tous ses grands frugivores, tandis que Maurice en conserve encore malgré la perte de 95 % de ses habitats indigènes. C’est la perte précoce des habitats de basse altitude à La Réunion qui explique ce paradoxe.
- La perte des vertébrés frugivores a entraîné l’incapacité de la forêt tropicale humide à se reconstruire depuis plus de 200 ans sur les coulées de lave du Piton de la Fournaise.
- Une comparaison des forêts anciennes les mieux préservées de l’archipel montre que la régénération est très inquiétante à La Réunion en comparaison avec Maurice où les roussettes noires jouent un rôle clé de voûte.
- Il est possible de restaurer le recrutement de diverses espèces d’arbres via des semis directs.
- Néanmoins, le retour des grands frugivores assurerait une dispersion efficace pour de multiples plantes indigènes.
Notes
Image de couverture. Vues d’artiste de vertébrés des Mascareignes avant la colonisation humaine. A gauche, interaction de frugivorie dans un sous-bois mauricien entre les fruits charnus d’une Sapotacée endémique menacée (Sideroxylon) et : (i) à l’arrière-plan, le perroquet mauricien Lophopsittacus mauritianus (éteint au 17e siècle) qui était l’un des plus gros perroquets du monde, et (ii) au premier plan, la perruche verte à écho Psittacula eques echo (vulnérable), la seule espèce de perroquet indigène encore présente dans les Mascareignes. A droite, oiseaux perchés dans un rempart à La Réunion. Au premier plan, trois espèces de pigeons, dont le founingo bleu ardoisé (Alectroenas sp., éteint au 18e siècle) ; à l’arrière-plan, la perruche verte (Psittacula eques eques, éteinte au 18e siècle). Illustrations © Julian Hume reproduites avec l’autorisation de l’auteur.
[1] Janzen D.H. (1970) Herbivores and the Number of Tree Species in Tropical Forests. The American Naturalist, 104, p. 940 (DOI 10.1086/282687) ; Connell J.H. (1971) On the role of natural enemies in preventing competitive exclusion in some marine animals and in rain forest trees. Dans P. J. Den Boer & G. R. Gradwell, Dynamics of Population, Wageningen: Pudoc ; Terborgh J. et al. (2008) Tree recruitment in an empty forest. Ecology, 89, 1757-1768 ; http://doi.wiley.com/10.1890/07-0479.1.
[2] Jordano P. (2000) Fruits and Frugivory, in Seeds: the ecology of regeneration in plant communities, 2nd ed., M. Fenner, Éd. Oxon, UK ; New York: CABI Pub, p. 125 166.
[3] Albert S. (2020) Rupture des interactions mutualistes plantes à fruits charnus-vertébrés frugivores, et conséquences sur la régénération des forêts tropicales dans les Mascareignes, Doctoral dissertation, Université de La Réunion. Disponible sur : https://tel.archives-ouvertes.fr/tel-03126708
[4] McConkey K. R. et al. (2012) Seed dispersal in changing landscapes. Biol. Conserv., 146,1-13. Disponible sur : http://www.sciencedirect.com/science/article/pii/S0006320711004575
[5] Dirzo R., Young H. S., Galetti M., Ceballos G., Isaac N. J. & Collen B. (2014) Defaunation in the Anthropocene. Science, 345, 401-406 ; https://www.science.org/doi/abs/10.1126/science.1251817
[6] Guimarães P. R., Galetti M. & Jordano P. (2008) Seed dispersal anachronisms: rethinking the fruits extinct megafauna ate. PLoS ONE, 3(3) : e1745 ; https://doi.org/10.1371/journal.pone.0001745
[7] Albert S., Flores O., Rouget M., Wilding N. & Strasberg D. (2018) Why are woody plants fleshy-fruited at low elevations? Evidence from a high-elevation oceanic island. J. Veg. Sci., 29, 847-858 ; https://doi: 10.1111/jvs.12676.
[8] Cheke A. S. & Hume J. P. (2008) Lost land of the dodo : an ecological history of Mauritius, Réunion & Rodrigues. New Haven: Yale University Press.
[9] Nom vulgaire d’un genre de pigeons frugivores endémique des Îles du Sud-Ouest de l’Océan Indien. Voir https://fr.wikipedia.org/wiki/Pycnonotidae
[10] Nom vulgaire caractérisant des passereaux frugivores appartenant à la famille des Pycnonotidae. Voir https://fr.wiktionary.org/wiki/founingo
[11] Lougnon A. (2005) Sous le signe de la tortue : voyages anciens à l’Île Bourbon, 1611-1725, 5. éd. Sainte-Clotilde, Réunion : Orphie.
[12] McConkey K. R. & O’Farrill G. (2016) Loss of seed dispersal before the loss of seed dispersers ». Biol. Conserv., 201, 38-49 ; https://doi.org/10.1016/j.biocon.2016.06.024.
[13] La vanille y est cultivée par exemple
[14] Walker L. R., Wardle D. A., Bardgett R. D. & Clarkson B. D. (2010) The use of chronosequences in studies of ecological succession and soil development. J. Ecol., 98, 725-736 ; https://doi.org/10.1111/j.1365-2745.2010.01664.x.
[15] Ceballos G., Ehrlich P. R. & Dirzo R. (2017) Biological annihilation via the ongoing sixth mass extinction signaled by vertebrate population losses and declines, Proc. Natl. Acad. Sci. USA, 114 (30) E6089-E6096 ; https://doi.org/10.1073/pnas.1704949114.
[16] Duncan R. P., Boyer A. G. & Blackburn T. M. (2013) Magnitude and variation of prehistoric bird extinctions in the Pacific. Proc. Natl. Acad. Sci. USA, 110 (16) 6436-6441 ; https://doi.org/10.1073/pnas.1216511110.
[17] Heinen J. H., van Loon E. E., Hansen D. M. & Kissling W. D. (2017) Extinction-driven changes in frugivore communities on oceanic islands. Ecography, 41(8), 1245-1255 ; https://doi.org/10.1111/ecog.03462.
[18] Albert S., Flores O., Ah-Peng C. & Strasberg D. (2021) Forests without frugivores and frugivores without forests – an investigation into the causes of a paradox in one of the last archipelagos colonized by humans. Front. Ecol. Evol., 9, article 688768 ; https://doi.org/10.3389/fevo.2021.688768.
[19] Albert S., Flores O. & Strasberg D. (2020) Collapse of dispersal trait diversity across a long-term chronosequence reveals a strong negative impact of frugivore extinctions on forest resilience. J. Ecol., vol. 108(4), 1386‑1397 ; https://doi.org/10.1111/1365-2745.13359.
[20] Effiom E. O., Nunez-Iturri G., Smith H. G., Ottosson U. & Olsson O. (2013) Bushmeat hunting changes regeneration of African rainforests. Proc. R. Soc. B Biol. Sci., 280 (759) 20130246 ; https://doi.org/10.1098/rspb.2013.0246.
[21] Harrison R. D. et al. (2013) Consequences of defaunation for a tropical tree community. Ecol. Lett., 16(5), 687-694 ; https://doi.org/10.1111/ele.12102.
[22] Albert S., Flores O., Baider C., Florens F. B. V. & Strasberg D. (2021) Differing severity of frugivore loss contrasts the fate of native forests on the land of the Dodo (Mascarene archipelago). Biol. Conserv., 257, 109131 ; https://doi.org/10.1016/j.biocon.2021.109131.
[23] Albert S. et al. (2017) Rediscovery of the mistletoe Bakerella hoyifolia subsp. bojeri (Loranthaceae) on Reunion Island: population status assessment for its conservation. Bot. Lett., 164(3), 229-236 ; https://www.tandfonline.com/doi/full/10.1080/23818107.2017.1340191.
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : ALBERT Sébastien (26 juillet 2024), Comment les extinctions de vertébrés menacent les forêts tropicales, Encyclopédie de l’Environnement. Consulté le 6 décembre 2025 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/vivant/extinctions-vertebres-menacent-forets-tropicales/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.







