Les premiers écosystèmes complexes
PDF
Les écosystèmes actuels sont étonnants par la complexité des liens d’interdépendance entre les organismes qui les constituent. Énergie et biomasse circulent à travers des réseaux trophiques qui unissent bactéries, organismes unicellulaires, et animaux de nature et de taille extrêmement variées. La stabilité de ces systèmes biologiques repose sur des équilibres dynamiques cependant très sensibles aux facteurs environnementaux et anthropiques. Pendant plus de trois milliards d’années, les écosystèmes marins ont été dominés par des organismes microbiens (bactéries, archées) ou eucaryotes unicellulaires. Ces organismes ont certes joué un rôle clé dans les cycles biogéochimiques du carbone ou de l’azote et dans l’élévation du niveau d’oxygène sur notre planète mais ils n’ont jamais constitué de réseaux trophiques complexes tels que nous les connaissons dans la nature actuelle. Il y a un peu plus de 500 millions d’années, l’apparition d’organismes pluricellulaires et macroscopiques à la fin du Précambrien puis l’avènement du règne animal au cours de la transition Précambrien-Paléozoïque vont révolutionner le monde marin et son mode de fonctionnement.
1. L’énigmatique écosystème marin de l’Ediacarien

Présents dans de nombreux sites fossilifères au Canada (ex : Mistaken Point), en Australie (ex : Ediacara), en Namibie et dans le nord de la Russie (ex : Mer Blanche), ces organismes énigmatiques ont colonisé en abondance les fonds marins à des profondeurs variables entre 575 et 542 millions d’années, un intervalle géologique correspondant à la fin de l’Ediacarien. Les empreintes de leurs corps mous, molletonnés et flexibles, sans aucun équivalent dans la nature actuelle, ont été conservées grâce au dépôt instantané de sédiments sableux ou de cendres volcaniques.
Parmi les plus typiques, les rangeomorphes [1] se caractérisent par une frondeStructure d’un organe ou d’un organisme vivant, aplati, de taille assez grande, en forme de feuille. ondulante et une tige solidement ancrée sur le fond. Ces organismes fixés, uniques par leur structure modulaire et fractale, n’atteignent toutefois pas la complexité anatomique des premiers animaux du Cambrien. Apparemment dépourvus de bouche, de système digestif et d’organes internes complexes, on pense qu’ils extrayaient leur nourriture par absorption directe du carbone organique dissous (osmotrophieMode d’alimentation qui consiste à se nourrir à partir de substances dissoutes. La nutrition des organismes osmotrophes est assurée par échange transmembranaire, c’est-à-dire par diffusion d’ions ou de petites molécules au travers de la membrane cytoplasmique. Ce type de nutrition, très répandu chez les micro-organismes, est également le fait d’un certain nombre d’animaux, libres ou parasites. Il n’est possible que dans des environnements liquides (milieux aquatiques, fluides intérieurs d’animaux ou de végétaux) ou par la synthèse d’enzymes qui « digèrent » leur environnement solide.) grâce à leur très grande surface d’échange avec le milieu.
A l’Ediacarien, l’interface eau-sédiment du fond des océans était également occupée par des éponges et de nombreux organismes aplatis évoquant parfois la symétrie bilatérale de certains mollusquesEmbranchement d’animaux invertébrés, non segmentés, à symétrie bilatérale quelquefois altérée. Ils ont un corps mou (d’où le nom de mollusque) composé généralement d’une tête, d’une masse viscérale, et d’un pied. Ils peuvent être pourvus d’une coquille calcaire produite par un manteau recouvrant la masse viscérale. et arthropodesEmbranchement d’animaux invertébrés dont le plan d’organisation est caractérisé par un corps segmenté avec des appendices articulés et recouvert d’une cuticule ou d’une carapace rigide, qui constitue leur exosquelette, dans la plupart des cas constitué de chitine. Apparus il y a 543 millions d’années, l’embranchement des arthropodes est de très loin celui qui possède le plus d’espèces et le plus d’individus de tout le règne animal (80 % des espèces connues). actuels (Figure 1). Les traces produites par certains d’entre eux tels que Kimberella, Dickinsonia et Yorgia indiquent qu’ils se déplaçaient et consommaient les films bactériensAussi appelé biofilms ; communauté microbienne marquée par la sécrétion d’une matrice adhésive et protectrice. Il se forme généralement dans l’eau ou en milieu aqueux. Les biofilms ont sans doute constitué les premières colonies d’organismes vivants, il y a plus de 3,5 milliards d’années. Avec les stromatolithes, ils semblent à l’origine des premières roches biogéniques et structures récifales. qui tapissaient alors l’ensemble des fonds marins, sans doute par digestion externe le long de leur surface ventrale comme chez les placozoairesMétazoaires (animaux) présentant le plan d’organisation le plus simple. Ces minuscules (entre 1 et 3 mm) animaux aplatis ne présentent ni symétrie, ni bouche, ni tube digestif, ni système nerveux, ni lame basale. Ils ne possèdent pas d’organes et seulement quatre types différents de cellules somatiques. actuels. Les organismes de l’Ediacarien, dans leur immense majorité, semblent appartenir à des lignées évolutives apparues avant celles des animaux au sens strict (EumétazoairesMétazoaires (animaux) supérieurs comprenant tous les principaux groupes d’animaux à part les éponges et les placozoaires.).
L’écosystème marin de cette époque était essentiellement dominé par des tapis microbiens et des organismes pluricellulaires osmotrophes (ex : rangeomorphes), microphagesOrganisme consommateur d’aliments solides (particules) de très petite taille et doivent être absorbées en grande quantité. Les particules ingérées vont des débris organiques de quelques nanomètres aux mollusques et crevettes. Ce qui constitue une partie importante du krill dont se nourrissent les baleines. (ex : éponges via leur système filtreur et leurs cellules flagelléescaractéristiques de cellules ou d’organismes unicellulaires munis d’un ou de plusieurs flagelles, structure assurant leur mobilité.) ou utilisant la digestion externe de contact. Ces stratégies alimentaires étaient parfaitement adaptées aux ressources disponibles dans le milieu marin à la fin du Précambrien, à savoir un flux abondant de matière organique dissoute et des tapis microbiens omniprésents à l’interface eau-sédiment. L’extinction des organismes édiacariens au passage Précambrien-Cambrien ne serait pas due à un bouleversement environnemental planétaire comme la plupart des grandes crises biologiques mais plutôt à la destruction de leur biotopeLieu de vie ayant des caractéristiques physiques et chimiques déterminées relativement uniformes. Ce milieu héberge un ensemble de formes de vie composant la biocénose : flore, faune, micro-organismes. Un biotope et la biocénose qu’il accueille forment un écosystème. par les tout premiers animaux fouisseurs (bioturbationPhénomène de mélange actif des couches de sol ou d’eau par les espèces vivantes, animales principalement.). Entièrement dépourvus de défense, ces organismes n’auraient par ailleurs pas survécu aux premiers prédateurs.
2. Les premières communautés animales : prototype des écosystèmes modernes
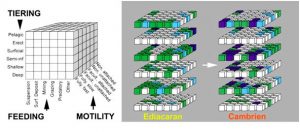
Par définition, l’Explosion Cambrienne désigne l’apparition relativement brusque dans le registre fossile, d’organismes à la fois nouveaux et complexes, parmi lesquels on reconnait avec certitude les lointains ancêtres des principaux groupes animaux actuels (ex : arthropodes, vers, mollusques, chordés ; Figure 2). Plusieurs gisements à préservation exceptionnelle (appelés LagerstättenMot allemand, pluriel, signifiant littéralement « zone de stockage ». Correspond à des sites géologiques d’une extrême richesse en fossiles remarquablement conservés.) comme ceux de Chengjiang (Chine ; env. 520 Ma), des Schistes de Burgess (Canada ; env. 505 Ma), de Sirius Passet (Groenland) et de Emu Bay (Australie) révèlent ainsi l’existence des premières communautés animales marines. Grâce à des capacités motrices et sensorielles déjà développées (ex : système nerveux céphalique parfois fossilisé) ces animaux du début du Cambrien pouvaient se déplacer activement dans leur milieu et exploiter pour la première fois une multitude de niches écologiques. Cette dynamique marque une différence fondamentale avec la vie marine essentiellement fixée de l’Ediacarien et un tournant irréversible dans l’évolution des écosystèmes.



– cnidairesEmbranchement (phylum) d’animaux aquatiques (essentiellement marins) que l’on retrouve sous deux formes : les polypes, lorsqu’ils sont fixés (c’est le cas du corail ou des anémones de mer), et les méduses lorsqu’ils sont nageurs.,
– cténophoresOrganismes marins prédateurs, hermaphrodites, de petite taille. Ils ont une vague ressemblance avec les méduses et constituent une part très importante du plancton.,
– chaetognatesEmbranchement (phylum) de prédateurs marins en forme de flèche dont le nom provient des crochets mobiles qui permettent la capture de leurs proies. Ils jouent un rôle majeur dans l’écosystème planctonique comme principaux prédateurs directs des copépodes et représentent jusqu’à 10 % de la biomasse du zooplancton.,
– mollusques et arthropodes primitifs (ex : IsoxysGenre éteint de petits arthropodes primitifs ayant vécu au Cambrien inférieur. Leur principale caractéristique est l’existence d’une carapace pointue bivalve.).
L’étude comparée de ces fossiles et de leurs descendants actuels (Figure 4) suggère que les espèces interagissaient au sein d’une chaîne alimentaire primitive [3], [4], [5], [6], [7], [8], [9], [10], [11]. L’espèce Timisiocaris du Cambrien inférieur du Groenland est un bon exemple de ces nouvelles relations trophiques. Proche cousin du prédateur emblématique Anomalocaris, ses grands appendices étaient munis de peignes et de soies filtreuses lui permettant de capturer le zooplanctonPlancton animal. Il se nourrit de matière vivante, certaines espèces étant herbivores et d’autres carnivores. vivant en suspension dans la colonne d’eau. Des micro fossiles attestent de la présence de ce zooplancton consommateur d’algues eucaryotes et de bactéries.
La vie marine cambrienne se concentre toutefois à l’interface eau-sédiment, les éponges représentant une composante majeure de la faune sessileOrganismes vivant seuls ou en colonies et définitivement fixés directement sur le substratum. Ils sont le plus souvent aquatique. C’est par exemple le cas des éponges, des coraux, des hydrozoaires, des tuniciers, des bryozoaires, etc.. Les arthropodes sont de loin les organismes épibenthiquesOrganisme vivant à la surface du substratum dans la zone de fond marin. les plus abondants et les plus diversifiés dans tous les gisements à préservation exceptionnelle (Figure 2). Leur plan d’organisation externe (segments, appendices) et interne (système nerveux) suggère, pour certains d’entre eux, des relations de parenté avec les crustacés et les chélicératesGroupe d’arthropodes portant des chélicères, paire d’appendices proches de la bouche, correspondant à la deuxième paire d’antennes chez les mandibulates (crustacés, insectes…). Ce groupe comprend les mérostomes (limules) et les arachnides (araignées, scorpions, etc.). Seules les limules sont des animaux marins et vivant sur le fond. actuels.
D’autres appartiennent à des groupes aujourd’hui éteints. Leur exosquelette articulé et multi-segmenté a probablement favorisé l’acquisition de nombreuses fonctionnalités et spécialisations. Des appendices préhensiles et masticateurs permettent aux arthropodes cambriens de capturer des proies et de réduire les particules alimentaires. La macrophagie fait son apparition au Cambrien chez de nombreux animaux prédateurs ou se nourrissant de cadavres (nécrophages). Par exemple, l’arthropode Sidneyia des Schistes de Burgess capturait, broyait et consommait de petits trilobitesClasse d’arthropodes marins fossiles ayant existé durant le Paléozoïque (ère primaire) du Cambrien au Permien. Les derniers trilobites ont disparu lors de l’extinction de masse à la fin du Permien, il y a 250 Ma. comme l’indiquent ses appendices et ses contenus stomacaux (Figure 2).
D’autres innovations contribuent aux grands changements qui s’opèrent au sein de la chaîne alimentaire. Des glandes digestives augmentent l’efficacité de la dégradation enzymatique de la nourriture favorisant ainsi la macrophagieMode de nutrition d’un organisme vivant qui se nourrit de proies de grande taille par rapport à lui. chez de nombreux arthropodes cambriens. La vision a également révolutionné les interactions entre les organismes marins dès le début du Cambrien. Ainsi, des yeux composés de grande taille constitués de milliers de facettes permettaient au super-prédateur Anomalocaris de repérer et traquer ses proies. Il ne fait aucun doute que la vision, largement répandue chez les arthropodes cambriens, a considérablement modifié les relations proies-prédateurs et introduit de nouvelles pressions de sélection au sein de l’écosystème, entrainant de multiples réponses adaptatives.
Références et notes
Photo de couverture : La vie dans la mer d’Ediacara © Ryan Somma [CC BY-SA 2.0], via Wikimedia Commons
[1] Narbonne G.M., Laflamme M., Greentre C. & Trusler P. (2009) Reconstructing a lost world: Ediacaran rangeomorphs from Spaniard’s Bay, Newfoundland. Journal of Paleontology 83, 503-528.
[2] Fedonkin M.A., Gehling J.G., Grey K., Narbonne G. & Vickers-Rich P. (2007) The Rise of Animals. The Johns Hopkins University Press, Baltimore. 325 pp.
[3] Briggs D.E.G. (2015) The Cambrian Explosion. Current Biology 25, R864-R868
[4] Caron J.-B., Scheltema A., Schander C. & Rudkin D. (2006) A soft-bodied mollusc with radula from the Middle Cambrian Burgess Shale. Nature 442, 159-163.
[5] Caron J.-B., Conway Morris S. & Cameron C.B. (2013) Tubicolous enteropneusts from the Cambrian period. Nature 495, 503-506.
[6] Daley et al. (2009) The Burgess Shale anomalocaridid Hurdia and its significance for early euarthropod evolution. Science 323, 1597-1600.
[7] Hou X.-G., Aldridge R.J., Bergström J., Siveter David J., Siveter Derek J. & Feng X.-H. (2004) The Cambrian Fossils of Chengjiang, China. Blackwell Publishing. 233 pp.
[8] Smith M.R. & Caron J.-B.(2010) Primitive soft-bodied cephalopods from the Cambrian. Nature 465, 469-472.
[9] Vannier J., Steiner M., Renvoisé E., Hu S.-X. & Casanova J.-P. (2007) Early Cambrian origin of modern food webs: evidence from predator arrow worms. Proceedings of the Royal Society London B 274, 627-633.
[10] Vannier J., Garcia-Bellido D.C., Hu S.-X. & Chen A.L. (2009) Arthropod visual predators in the early pelagic ecosystems: evidence from the Burgess Shale and Chengjiang biota. Proceedings of the Royal Society London B 276, 2567-2574.
[11] Vinther J., Stein M., Longrich N.R. & Harper D.A.T. (2014) A suspension-feeding anomalocarid from the Early Cambrian. Nature 507, 496-500.
[12] Bambach R.K, Bush A.M. & Erwin D.H. (2007) Autecology and the filling of ecospace: key metazoan radiations. Palaeontology 50, 1-22.
[13] Erwin D.H. & Valentine J.W. (2013) The Cambrian Explosion: the construction of animal biodiversity. Roberts & Company Publishers. 406 pp.
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : VANNIER Jean (14 avril 2022), Les premiers écosystèmes complexes, Encyclopédie de l’Environnement. Consulté le 17 février 2026 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/vivant/premiers-ecosystemes-complexes/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.




