« The Philly Killer » : Émergence de Legionella pneumophila, bactérie ubiquitaire de l’environnement
PDF
Juillet 1976, Bellevue Stratford Hotel à Philadelphie (Pennsylvanie – USA, voir Figure 1). La chaleur est étouffante, le conditionnement d’air tourne à plein régime… Plusieurs centaines de vétérans de « l’American Legion » y sont réunis en Congrès. A la fin du congrès, une épidémie soudaine de pneumonies graves se développe sur plusieurs jours consécutifs dans des villes environnantes : 147 légionnaires sont hospitalisés, 29 (16%) succombent. Aucune étiologie classique n’est trouvée. Une véritable enquête policière démarre alors sous l’égide des « Centers for Disease Control and Prevention » d’Atlanta (CDCP), afin de détecter « le tueur» : celui-ci reste inconnu pendant plusieurs mois ; en fait il s’agit d’une nouvelle bactérie pathogène pour l’homme, appelée par la suite « Legionella pneumophila » qui a pour biotope les eaux douces. Une nouvelle maladie d’origine environnementale était née : la légionellose !
1. Il y a 50 ans … émergence de la légionellose

Dès la survenue de l’épidémie, une cinquantaine d’épidémiologistes de l’Epidemic Intelligence Service (EIS) sont déployés sur l’Etat, appuyés par de nombreux experts microbiologistes, chimistes ou toxicologues… (Figure 2). Néanmoins, toutes les recherches d’agents connus restent négatives. Six mois plus tard, McDade revient aux techniques de Robert Koch, passant par l’inoculation chez le cobaye de biopsie pulmonaire de patients décédés, puis subcultures sur œuf embryonné, qui permettent enfin d’observer des formes bactériennes ! Au cours de l’année qui suit, les principales caractéristiques de la maladie et de l’agent infectieux déclenchant sont définies : « Pneumonie provoquée par un bacille à Gram négatif, de culture difficile, survenant le plus souvent chez des sujets « à risques » (hommes âgés, fumeurs), mortalité de 10%, porte d’entrée respiratoire, cause probable de transmission : le système de climatisation ». L’épidémie est relayée par la presse dans le monde entier et fut même immortalisée par une chanson de Bob Dylan « Legionnaires‘ Diseases » !

2. Carte d’identité de « la bactérie tueuse » : Legionella pneumophila
2.1. Qui est-elle ?
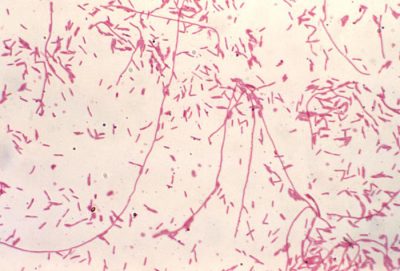
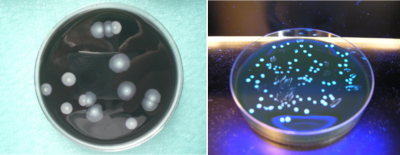
Aujourd’hui, ce n’est plus une, mais 65 espèces, qui sont décrites, la plus fréquente et la plus pathogène pour l’homme étant L. pneumophila SG (sérogroupe) 1. Le pouvoir pathogène réside surtout dans la présence de très nombreux facteurs impliqués dans sa multiplication intracellulaire dont le Macrophage Infectivity Potentiator (MIP) et de trois systèmes de sécrétion dont le plus important est de type IV [7].
Parmi les souches séquencées, L pneumophila Paris et L. pneumophila Lens, montrent un génome de 3,7 millions de paires de base (Mpb). Leur analyse montre notamment la présence de gènes codant pour des protéines ayant des homologies avec leurs deux hôtes connus : les amibes libres* et l’homme. Ultérieurement, des homologies avec des protéines d’hôtes différents ont été caractérisées, expliquant la capacité d’adaptation de ce micro-organisme [8], notamment celle de l’espèce la plus pathogène chez l’homme : L. pneumophila de sérogroupe 1.
2.2. Quels sont ses biotopes ?

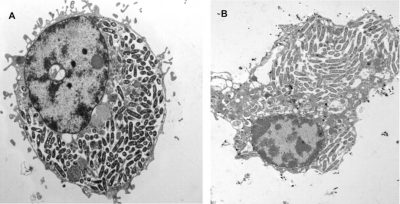
- Dans des amibes libres*, protistes* non parasites qui effectuent en totalité leur cycle dans l’environnement et qui dans l’eau, phagocytent des micro-organismes pour se nourrir, dont les Legionella. Mais celles-ci ont « une résistance » naturelle aux amibes, elles s’internalisent dans une vacuole nommée Legionella-Containing Vacuole (LCV) qui constitue un site de multiplication privilégiée dans l’environnement ; ainsi les Legionella « s’abritent » dans les amibes et résistent aux stress environnementaux (Figure 6) [11]. Ces eucaryotes (genres Acanthamoeba, Hartmanella…) deviennent dès lors un réservoir potentiel de contamination.
- Dans des biofilms* bactériens [12]. Un biofilm (lire Biofilms bactériens et santé) est composé d’un environnement dynamique associant des micro-organismes enfermés dans une matrice extracellulaire et adhérents à des surfaces physico-chimiques : modèle qui s’applique aux Legionella. Mais les biofilms peuvent également se trouver à la surface de milieux liquides stagnants ou « floating biofilms »: ceux-ci jouent un rôle primordial dans la persistance des bactéries dans des réservoirs parfois inaccessibles, difficiles à éradiquer par les produits désinfectants utilisés.

- Sous forme de bactéries viables mais non cultivables [13] (VBNC). Celles-ci apparaissent sous l’effet de stress, qui les rendent momentanément incapables de se multiplier à cause de leur activité métabolique faible. Néanmoins si les conditions redeviennent favorables, elles peuvent retrouver leur pouvoir pathogène.
- Les gites artificiels ou anthropiques : tours aéro-réfrigérantes (Figure 7) (TAR : abréviation classiquement utilisée dans les documents techniques) et eaux chaudes sanitaires (ECS) [14],[15]. A partir des sites naturels, les Legionella peuvent coloniser des sites artificiels et se multiplier si la température le leur permet (25 à 45°C). Ainsi tout dispositif ou réseau comportant de l’eau chaude constituera une niche potentielle pour les Legionella. Historiquement, les installations de climatisation, les tours aéroréfrigérantes ou les tours de refroidissement ont été incriminées : d’où le mot « climatisation » systématiquement collé à celui de « légionellose » ! Par la suite il a été démontré que l’ensemble des réseaux d’eau chaude sanitaire « modernes » pouvaient être potentiellement colonisés, avec des zones plus à risques comme les douches, les bains bouillonnants, les fontaines décoratives…
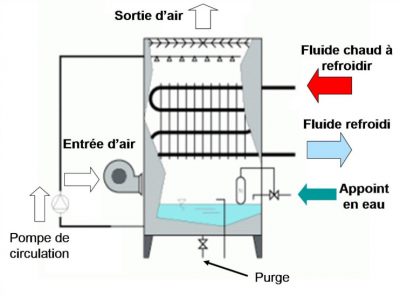
- Les tours aéroréfrigérantes furent le premier gite incriminé. Les circuits chauds industriels ou les groupes frigorifiques utilisés en climatisation (industrie, commerce) sont favorables au développement des Legionella (température de l’eau et contact air/eau dans les installations). Les tours aéroréfrigérantes humides situées à l’extérieur des bâtiments sont des systèmes de refroidissement de ces circuits chauds aboutissant à la formation d’aérosols constitués de fines gouttelettes sortant des bouches d’aération. Selon leur emplacement par rapport à la population, le risque sera plus ou moins grand. Les exemples foisonnent ; citons un arrêt de bus pour joueurs de golf se trouvant sous les retombées, la récupération involontaire des vapeurs relâchées par les immeubles eux-mêmes ou par les immeubles voisins. Les tours aéroréfrigérantes industrielles sont moins nombreuses, mais l’épidémie survenue à Lens (1997) a montré l’implication d’une tour située à 8 km voire 16 km du domicile de patients contaminés ! (Figure 8)

- L’eau chaude sanitaire (Figures 9 & 10) est une eau initialement froide à usage domestique, destinée à la consommation humaine qui sera chauffée secondairement. Ce fut le second site incriminé avec la constatation par Susan Fisher-Hoch de cas en Angleterre où la climatisation était peu présente [16]. Distribuée par le réseau, l’eau est chauffée par différents moyens, individuels ou collectifs, chaudières, ballons d’eau chaude etc. L’eau est ensuite distribuée par une tuyauterie plus ou moins longue jusqu’aux points de puisage (robinets, douches) : elle devient alors une eau chaude sanitaire.
Les Legionella, potentiellement présentes dans l’eau froide en très faible concentration, pourront ainsi s’y multiplier si les conditions de température le lui permettent. L’eau chaude contaminée devient dangereuse lorsqu’elle est transformée en aérosols : c’est le cas par exemple des douches, spas, brumisations, fontaines décoratives, ou de façon plus anecdotique mais réelle les dispositifs de lavage de voitures, des jets utilisés en dentisterie…

D’autres gites sont beaucoup plus rares, dont le sol humide type « terreau de rempotage », où le compost peut être contaminé par une espèce particulière, L. longbeachae, également pathogène pour l’Homme.
2.3. Comment la bactérie a-t-elle émergé chez l’homme?
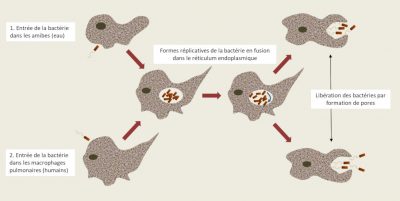
Ces particularités font que la légionellose n’est pas une maladie transmissible d’Homme à Homme (une seule exception au Portugal publiée en 2016), mais une maladie opportuniste dont la survenue dépend beaucoup de facteurs de risques individuels !
2.4. Qu’est – ce que la légionellose ?
- âge> 50 ans (la légionellose est rare chez l’enfant et chez les moins de 20 ans) ;
- tabagisme (45% des cas) ;
- sexe masculin (75% des cas).
D’autres patients ayant en plus un système immunitaire affaibli (hémopathies malignes, cancers, traitements immunosuppresseurs, corticothérapie prolongée), voire une pathologie cardiaque ou pulmonaire chronique, un diabète, nécessiteront des mesures de prévention et de surveillance très réglementées et encadrées avec notamment un seuil obligatoire « Zéro Legionella » dans les ECS.
La légionellose est une maladie grave, d’où l’importance d’un diagnostic précis dans un but thérapeutique mais aussi dans un objectif de surveillance. Il repose sur l’association d’une pneumopathie et de la positivité d’un, au moins, des 4 critères microbiologiques suivants [19] (Figure 12) :
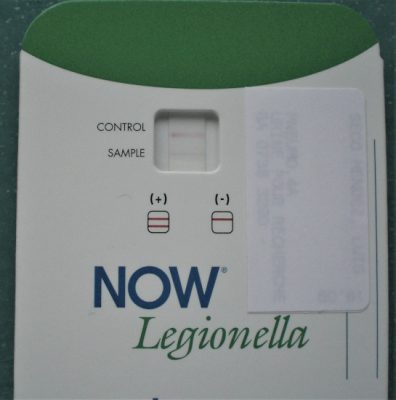
- La présence d’antigène soluble de Legionella dans les urines test NOW Legionella (Figure 13) ;
- La recherche d’ADN par technique de PCR directement dans le prélèvement broncho-pulmonaire ;
- L’isolement de la bactérie en culture dans des prélèvements pulmonaires (expectoration ou lavage broncho-alvéolaire) puis typage de la souche isolée ;
- Une confirmation a posteriori peut être apportée par mise en évidence d’une séroconversion.
3. Que sait-on de l’épidémiologie de la Légionellose aujourd’hui en France et en Europe ?
L’épidémiologie est en médecine la branche qui traite de l’incidence et de la prévalence d’une maladie chez un grand nombre d’individus, de la détection de la source et de l’agent causal dans une épidémie.
Aujourd’hui, différents types d’analyses sont conduits, permettant de déboucher sur une épidémiologie descriptive fiable :
- Définition par les autorités de tutelle de critères permettant de classer les cas de légionelloses à déclarer en « confirmés » ou « probables », selon les résultats des examens biologiques obtenus,
- le classement en « cas nosocomial* » ou « cas communautaire » selon le lieu d’acquisition de la maladie,
- Les répartitions selon de nombre de personnes touchées par une même souche : cas isolé ou cas groupés ou cas épidémiques (voir Tableau).
- Enfin les cas liés à un voyage dans un pays autre que la France sont notifiés auprès du Réseau Européen de Surveillance des Légionelloses EldsNet [21].
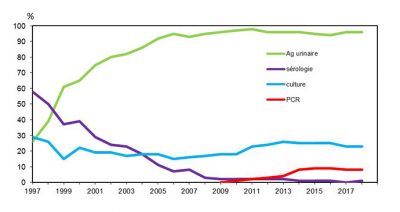
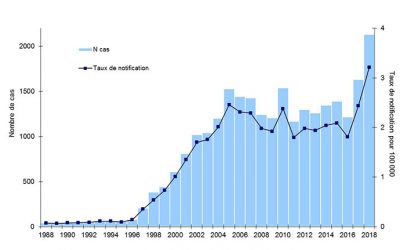
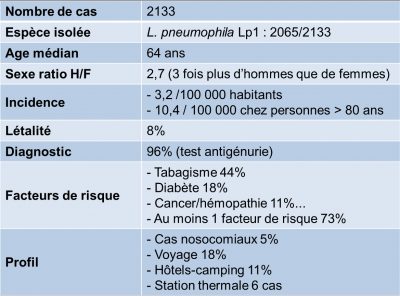
En France, l’épidémiologie des cas de légionelloses survenus en 2018 (publiée en aout 2019) met en évidence des caractéristiques résumées dans le Tableau 1 ; dans son commentaire « Santé publique France» [22] insiste sur cette nette augmentation : 2 133 cas et une incidence nationale de 3,2%, chiffres les plus élevés depuis la surveillance en 1988. Il n’y a pas de cause particulière retrouvée sauf une augmentation nette des cas en juin (météorologie favorisante), de nombreux cas sporadiques et pas de nouveau facteur de risques.
Tableau 1. Données épidémiologiques des cas de légionellose en 2018 extraites de « Données de Santé publique France 2019 » (voir Ref. [19]).
En Europe, la notification des cas relève de l’ECDC (European Center for Disease Prevention and Control). Cette surveillance est effective dans trente pays européens. Le nombre de cas rapportés est passé de 5 835 en 2013 à 9 238 en 2017 [23]. L’incidence est de 1,8/100 000 habitants. Les quatre pays qui déclarent le plus de cas sont en 1er l’Italie : 2013 cas, 2e la France : 1 630 cas, 3e l’Espagne : 1 363 cas, 4e l’Allemagne : 1 280 cas ; mais ces chiffres sont à prendre avec prudence car tous les pays ne disposent pas des moyens diagnostiques les plus récents. Or les tests utilisés et le système de surveillance ont une grande importance dans l’exactitude des données.
Notons pour les USA une incidence annuelle en 2014 de 1,62 cas pour 100 000 habitants, en augmentation depuis 2000 (0,42 cas).
4. Est-il possible de prévenir la légionellose ?
4.1. Quels sont les moyens de surveillance de l’eau ?
Il n’y a pas de vaccination possible contre la légionellose ! Par conséquent, toute la stratégie de prévention repose sur des mesures individuelles ou collectives.
Les moyens de prévention ciblés sur les eaux chaudes sanitaires et les tours aéroréfrigérantes sont fondés sur plusieurs textes réglementaires fondamentaux [24] : Guide d’investigation et d’aide à la gestion du Haut Conseil à la Santé Publique, 11 juillet 2013 – Arrêté du 1er février 2010 – Circulaire du 23 décembre 2010 – Arrêté du 14 décembre 2013.
Règle générale pour l’eau chaude sanitaire : (cf. fiche de surveillance éditée par l’Agence Régionale de Santé Ile-de-France
- Qu’il s’agisse d’eau chaude individuelle ou collective, il faut maîtriser en permanence la température des eaux chaudes des ballons qui doit être :
- > 55°C en sortie de production,
- > à 50°C en tout point de distribution,
- La température de l’eau froide doit être à < 20°C.
- Il faut assurer une maintenance et une surveillance régulières des installations d’eau chaude: supprimer la stagnation de l’eau dans les canalisations, vérifier l’absence de corrosion des tuyaux et d’entartrage au niveau des embouts des robinets et des pommeaux de douche, remédier au mauvais entretien du réseau.
Prévention individuelle « chez soi ». En plus des règles ci-dessus, 2 précautions importantes :
- Après une absence prolongée (post – vacances !), il est indispensable de laisser couler l’eau chaude de la douche pendant plusieurs minutes.
- Faire attention aux points d’eaux rarement utilisés, qui sont des réservoirs potentiels de Legionella.
Les installations à risques sont classées en deux groupes selon leur activité anthropique :
- Groupe A : installations à haut risque de dispersion des Legionella.
- A1: à l’échelle d’une ou plusieurs communes (plusieurs centaines de mètres ou plusieurs Km). C’est le cas des TAR, équipements situés sur les toits d’immeubles ou de sites industriels, nécessaires au refroidissement de l’air. La contamination est due aux vapeurs chaudes relâchées dans l’atmosphère. Pour prévenir ces contaminations, il faut entretenir, nettoyer et désinfecter régulièrement la TAR avec des biocides.
- A2 : plusieurs mètres autour de la source commune : réseaux collectifs d’eau chaude sanitaire.
- Groupe B :
- B1 : équipements collectifs de brumisation d’eau, spas, lavage de véhicules, lagunage des stations d’épuration des eaux usées, équipements professionnels avec eau sous pressions.
- B2 : équipements utilisés en oxygénothérapie, dans l’apnée du sommeil, pour la nébulisation de médicaments, en soins dentaires.
4.2. Comment sait-on que le réseau est contaminé ?
La recherche dans l’eau est bien codifiée par une Norme AFNOR (NF T 90-431) appelée « Qualité de l’eau. Recherche et dénombrement de Legionella spp et Legionella pneumophila » : c’est une méthode par ensemencement direct et après concentration. Elle s’applique à tous les types d’eaux : les eaux propres et les eaux sales. Depuis 2010 une norme NF T90-471 utilisant la biologie moléculaire type PCR existe : cette technique est effectuée en cas de demande spécifique par les autorités sanitaires.
4.3. Quelles sont les obligations pour les établissements recevant du public ?
Pour ces établissements, l’arrêté du 1er février 2010 et la circulaire du 21 décembre 2010 (voir ref. [19]) doivent être appliqués pour prévenir les contaminations des réseaux d’eau chaude. Ils sont relatifs à la surveillance des Legionella dans les installations de production, de stockage et de distribution d’eau chaude sanitaire dans les établissements de santé, les établissements sociaux et médico-sociaux et les établissements pénitentiaires, les hôtels et résidences de tourisme, les campings et autres établissements recevant du public.
D’autres textes, consultables sur Internet, s’appliquent spécifiquement à tout type d’établissements recevant du public, allant des campings aux hôtels :
- surveillance des spas et des piscines,
- Surveillance des sources thermales,
- Surveillance des laveurs de voitures,
- Surveillance des établissements touristiques,
- Surveillance des tours aéroréfrigérantes (20 janvier 2014),
- Recommandations pour les immeubles d’habitation…
Pour les hôpitaux, des circulaires de la Direction Générale des Soins et du Conseil Supérieur d’Hygiène de France ont aidé les professionnels de santé à appréhender les risques pour les malades hospitalisés, ce qui a permis d’élaborer un guide . Sur le terrain, les Comités de Lutte contre les Infections Nosocomiales (CLIN) et les Unités d’hygiène ont élaboré des procédures, dont la mise en place d’un« carnet de surveillance de la qualité de l’eau [25]».
4.4. Que faire en cas de contamination ?

Si le réseau d’eau est contaminé par des Legionella, le gestionnaire du réseau doit immédiatement mettre en œuvre les mesures adéquates en fonction du niveau de risque [26].
S’il s’agit d’établissement de soins ou d’un EHPAD, des mesures de correction immédiate seront appliquées : arrêt de l’utilisation de l’eau et/ou la mise en place sur les robinets et douches de filtres à usage unique arrêtant toute particule > 0,2 micromètres (circulaires du 22 avril 2002 et du 28 octobre 2005). [26]
Lors d’une désinfection simple : divers procédés sont appliqués, seuls ou associés. Ils peuvent être :
- Soit mécaniques : détartrage de la tuyauterie, réfection…
- Soit physiques notamment le choc thermique. Utilisé uniquement dans les réseaux d’eau chaude, il consiste à maintenir la température de l’eau à 70°C pendant au moins 30 minutes. Ce procédé a été utilisé dans des établissements hospitaliers de taille moyenne, mais il nécessite l’arrêt total de l’utilisation de l’eau au moment du chauffage général et la présence de personnels à chaque point d’usage pour éviter les brûlures.
- Soit encore chimiques : ce sont des agents chimiques très contrôlés, dont les principaux sont des composés chlorés générant des hypochlorites.
5. Messages à retenir
- Au cours de la décennie 1970-80, trois grandes maladies infectieuses d’origine bactérienne ont émergé : (1) Borrelia burgdorferi agent de la maladie de Lyme, (2) Helicobacter pylori responsable de l’ulcère gastrique, (3) Legionella pneumophila et la légionellose.
- Chaque fois, ce sont des circonstances de hasard qui ont permis de découvrir les bactéries qui en étaient la cause. En fait, celles-ci existaient depuis longtemps, mais elles étaient ignorées !
- Les Legionella existaient très certainement dans les eaux environnementales bien avant la survenue de l’épidémie de Philadelphie, mais elles étaient méconnues car elles n’avaient pas encore eu l’opportunité de rencontrer l’Homme.
- C’est l’Homme qui, avec l’eau chaude et la multiplicité de ses usages dans un but de confort et d’agrément ou pour répondre à des exigences industrielles, a fait éclore un nouveau risque, totalement imprévisible.
- Les Legionella étant ubiquitaires dans les eaux douces environnementales, leur éradication dans l’environnement est impossible.
- Il est de notre responsabilité à tous de promouvoir et faire appliquer des règles strictes de bon usage de l’eau chaude et de prévention de sa contamination, règles qui doivent avant tout être mises en pratique pour protéger les personnes « à risques ».
Notes et références
Image de couverture. Montage de quelques couvertures de presse sur la légionellose.
[1] Fraser DW, Tsai TR, Orenstein W. et al. Legionnaires’ disease: description of an epidemic of pneumonia. N. Engl. J. Med. 1977, 297, 1189-1197
[2] McDade JE, Shepard CC, Fraser DW et al. Legionnaires’disease. Isolation of a bacterium and demonstration of its role in other respiratory disease. N. Engl. J. Med. 1977, 297, 1197-1203
[4] Thomas G. & Morgan-Witts M., Trauma – The search for the cause of Legionnaires’ disease. Arrow Books, 1981 ; Thomas G. & Morgan-Witts M., Trauma – A la recherche d’un virus assassin, Traduction française par Destanque P., Ed. Encre 1982.
[5] Brenner DJ, Steigerwalt A.G. & McDade J.E. Classification of the Legionnaires’ Disease bacterium : Legionella pneumophila, genus novum, species nova of the family Legionellaceae, familia nova. Ann. Intern. Med. 1979, 90, 656-658.
[6] Moliner C., Ginevra C., Jarraud S. et al. Rapid identification of Legionella species by mass spectrometry. J. Med. Microbiol. 2010, 59,273-284 ; Mish EA. Legionella : virulence factors and host response. Curr. Opin. Infect. Dis. 2016, 29, 280-286
[7] Moliner C., Ginevra C., Jarraud S. et al. Rapid identification of Legionella species by mass spectrometry.J. Med. Microbiol. 2010, 59,273-284 ; Mish EA. Legionella : virulence factors and host response. Curr. Opin. Infect. Dis. 2016, 29, 280-286
[8] Gomez-Valero L., Rusniok C., Carson D. et al. More than 18.000 effectors in the Legionella genus genome provide multiple, independent combinations for replication in human cells. Proc. Nat. Acad. Sci. USA 116 (6) 2265-2273 ; first published January 18, 2019 https://doi.org/10.1073/pnas.1808016116
[9] Fliermans C.B., Cherry W.B., Orisson L.H., Smith S.J., et al. Ecological distribution of Legionella pneumophila. Appl. Environm. Microbiol. 1981, 41, 9-16
[10] Orisson L.H., Cherry W.B., Fliermans C.B. et al. Characteristics of environmental isolates of Legionella pneumophila. Appl. Environm. Microbiol. 1981, 42, 109-115
[11] Molmeret M. et al. Amaoebae as training grounds for intracellular bacterial pathogens. Appl. Environ. Microbiol. 2005; doi:10.1128/AEM.71.1.20-28.2005
[12] Lau H.Y. & Ashbolt N.J. The role of biofilm and protozoa in Legionella pathogenesis: implications for drinking water. J. Appl. Microbiol. 2009,107,368-378 ; Steinert M., Hentschel U.& Hacker J. Legionella pneumophila : an aquatic microbe goes astray. FEMS Microbiol. Rev. 2002, 26, 149-162 ; Declerck P. Biofilms: the environmental playground of Legionella pneumophila. Env.Microbiol.2010, 12, 557-566 ; Abdl-Nour, Duncan C, Low D.E et al . Biofilms: the stronghold of Legionella pneumophila. Int J. Mol. Sci. 2013, 14, 21660-21675.
[13] Dietersdorfer E., Kirschner A., Schrammel B. et al. Starved viable but non-culturable (VBNC) Legionella can infect and replicate in amoebae and human macrophages. Water Res. 2018.
[14] Fields B.S., Benson R.F.& Besser R.E. Legionella and Legionnaires’ Disease: 25 years of investigation. Clin. Microbiol. Rev.2002, 13, 506-526
[15] Cunha B.A., Burillo A.&Bouza E. Legionnaires’ disease. Lancet 2016, 387, 376-385
[16] McCormick J.B. & Fisher-Hoch S. 1997. Chasseurs de Virus. Presses de la Cité, 498 pages
[17] Jarraud S., Reyrole M., Meugnier H. et al. Légionellose. Presse Med 2007, 36, 279-87 ; Jamilloud Y., Jarraud S., Lina G., et al. Legionella, légionellose, 2012, Med Sci (Paris) 28, 639-45.
[18] ANSM : Agence Nationale de Sécurité des Médicaments et des produits de Santé (remplace AFSSAPS)
[19] Bilan des cas de légionellose survenus en France en 2018 (août 2019) Santé Publique France. https://www.santepubliquefrance.fr/maladies-et-traumatismes/maladies-et-infections-respiratoires/legionellose/articles/bilan-des-cas-de-legionellose-survenus-en-france-en-2018
[20] Centre National de Référence des Légionelles. http://cnr-legionelles.univ-lyon1.fr/
[21] ELDSNet : European Legionnaires’ Disease Surveillance Network, coordonné par ECDC (European Center for Disease Prevention and Control), créé en 2005. EWGLI (European Working Group for Legionella Infections), créé en 1986, deviendra EWGLINET puis en 2010 devient ELDSNet.
[22] Santé Publique France. Depuis le 1er mai 2016, il regroupe : INVS (Institut National Veille Sanitaire), Inpes (Institut national de prévention et d’éducation pour la santé), Eprus (Etablissement de préparation et de réponse aux urgences sanitaires).
[23] European Centre for Disease Prevention and Control, Legionnaires’ disease. In : ECDC. Annual epidemiological report for 2017 (2019), Stockholm.
[24] https://www.hcsp.fr avis et rapports/guide d’investigation et d’aide à la gestion de cas de légionellose, https://www.iledefrance.ars.sante.fr/la-legionellose
[25] Cheron J. (2006) Maîtriser le risque légionelles. Ed. Johanet, 325 p.
[26] Prévention de la légionellose : les obligations par type d’installation et d’établissement
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : CROIZE Jacques (19 mai 2020), « The Philly Killer » : Émergence de Legionella pneumophila, bactérie ubiquitaire de l’environnement, Encyclopédie de l’Environnement. Consulté le 27 février 2026 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/sante/emergence-legionellose-legionella-pneumophila/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.







