Comment les oiseaux s’adaptent-ils à un climat qui change ?
PDF
Comment faire, quand on est un oiseau, pour s’accommoder d’un climat qui se réchauffe inexorablement ? Trois solutions : fuir sous des cieux plus cléments, s’adapter localement ou disparaître. Le mécanisme le mieux connu est la fuite qu’on appelle la « traque à l’habitat » : l’oiseau suit l’enveloppe thermique à laquelle il est adapté, en remontant en latitude ou en altitude. Une autre solution consiste à s’accommoder à la hausse des températures si la hausse n’est ni trop rapide ni trop forte. Mais le mécanisme le plus sûr est de s’adapter par microévolution, donc par modification de la structure génétique de la population. Quand, pour une raison ou pour une autre, aucun de ces mécanismes n’est possible l’extinction est inévitable. Les espèces vivant dans les milieux extrêmes (comme la toundra ou la haute montagne) sont particulièrement vulnérables à l’extinction puisque le déplacement de leurs habitats bute sur des limites géographiques. Certaines catégories d’oiseaux, notamment les migrateurs à longue distance qui fréquentent de nombreux habitats au cours de leurs déplacements, sont frappées de plein fouet par les nouvelles contraintes auxquelles elles ont à faire face.
1. D’immenses défis à relever
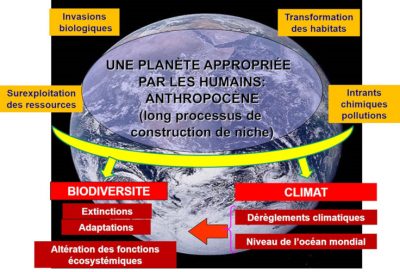
Les dérèglements climatiques dont presque plus personne ne conteste la réalité sont l’une des six composantes de ce qu’on appelle le « changement global », les autres composantes étant l’altération des habitats, les intrants chimiques, la surexploitation des ressources, les pollutions et les invasions biologiques (Figure 1). Leur principale caractéristique, qui leur valut le qualificatif de « global », est de concerner la planète entière, la plupart de leurs effets se faisant sentir partout dans le monde (Lire La biodiversité n’est pas un luxe mais une nécessité). S’agissant du climat, ces dérèglements se déclinent en six phénomènes : les concentrations de dioxyde de carbone, l’élévation des températures, la remontée du niveau de l’océan mondial, la fonte des masses glaciaires, l’extension des zones sèches et des déserts, et une multiplication des événements extrêmes (canicules, inondations, tempêtes et cyclones). Ces bouleversements sont les symptômes de l’anthropocénisation [1] de la planète et ont de sérieuses conséquences sur de multiples aspects des histoires de vie des organismes, à toutes les échelles d’espace, du local au global [2].
Le rythme des changements est si rapide et si abrupt que nous sommes confrontés à une série inédite “d’expériences naturelles” qui illustrent les défis que doivent relever les populations d’organismes confrontées à des environnements totalement nouveaux. Ces nouvelles conditions de vie risquent de mener les organismes à l’extinction, mais elles peuvent aussi leur offrir de nouvelles opportunités selon la réponse qu’ils apportent (ou pas) à ces changements (Lire L’adaptation des organismes à leur environnement). Les oiseaux sont l’objet de très nombreuses études sur leur vulnérabilité au réchauffement du climat et sur les réponses qu’ils y apportent. On s’attend à ce qu’ils soient particulièrement touchés [3] au point que chaque degré Celsius d’augmentation de la température de la planète pourrait entraîner l’extinction de 100 à 500 espèces [4].
2. La température, facteur clé en physiologie et en écologie
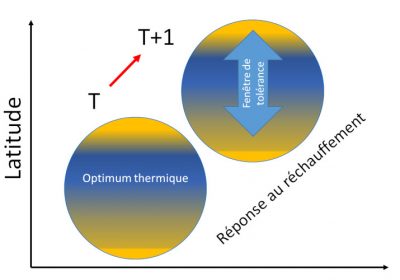
Les réponses des organismes au réchauffement du climat ont des effets en cascade d’un niveau de résolution du vivant au suivant :
- à l’échelle des individus, la température agit sur la croissance, la taille, la reproduction, donc globalement sur la valeur sélective (fitness) de l’individu.
- Puis les réponses individuelles se répercutent à l’échelle de la population par ses conséquences sur sa démographie, sa densité et sa diversité, tant phénotypique que génétique.
- Enfin, à l’échelle des assemblages d’espèces, les performances des populations se répercutent à l’échelle du peuplement en jouant sur sa composition, sa structure, sa production d’énergie, sa diversité spécifique et sa dynamique.
- Finalement, ce qui se passe à l’échelle du peuplement conditionne le fonctionnement de l’écosystème.
De nombreux exemples, notamment chez les oiseaux, illustrent la vulnérabilité des organismes aux variations de température, soit lorsque le seuil de tolérance thermique est atteint puis dépassé, soit par diminution de la productivité des écosystèmes, soit enfin par ruptures d’interactions entre espèces qui désorganisent les réseaux trophiques.
3. Quelles réponses des oiseaux au réchauffement du climat ?
Deux grands types de réponses au réchauffement climatique sont apportés par les oiseaux. Le premier est une réponse immédiate, d’ordre phénotypique, par laquelle l’oiseau ajuste « au coup par coup » son comportement à la variation de la température (Lire L’adaptation des organismes à leur environnement). Ce type de réponse est possible parce que chaque trait d’histoire de vie s’exprime à l’intérieur d’une « fenêtre de plasticité phénotypique » (Lire Focus Acclimatation ou adaptation ?) qui permet à l’organisme de répondre immédiatement à l’état de l’environnement. Le second, beaucoup plus difficile à mettre en évidence est une réponse adaptative aux nouveaux régimes de sélection. Il s’agit alors d’adaptation de type microévolutif, donc de nature génétique, en réponse aux nouvelles pressions de sélection exercées par l’environnement. Alors que la réponse phénotypique est immédiate, la réponse microévolutive est trans-générationnelle car elle passe par un crible sélectif directionnel qui s’exerce sur les descendants des variants génétiques qui présentent une variation avantageuse pour le trait considéré, par exemple la date de ponte ou le départ en migration.
3.1. La « traque à l’habitat »

Une remontée en latitude en réponse au réchauffement contemporain est avérée chez la majorité des espèces des deux groupes animaux terrestres les mieux étudiés, les oiseaux et les papillons [7],[8] (Figure 3). Cette remontée en latitude, sensible depuis les années 1990 chez 200 des 500 espèces nicheuses d’oiseaux d’Europe pour lesquelles on dispose de données [9], est largement confirmée, avec une forte accélération à partir des années 2000. Cela dit, bien que le réchauffement du climat joue un rôle certain dans les déplacements observés et mesurés, une grande précaution est de mise pour faire la part du climat et celle d’autres facteurs de l’environnement, en particulier les changements de la structure des habitats.
Mais toute interprétation faite sur des données de type corrélatif comporte une part d’incertitude car les aires de distribution peuvent changer sans qu’on ait toujours de bons arguments pour les expliquer. Bien des déplacements d’aires de distribution ne sont pas explicables par des mécanismes de réponse aux dérèglements du climat.
D’où l’importance de pouvoir démontrer formellement le rôle de l’élévation des températures dans les déplacements des organismes.
- Comment mesurer l’ampleur et la vitesse de déplacement ?
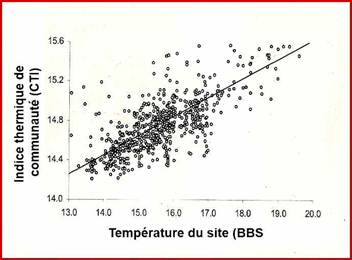
Ces données permirent à ces auteurs de calculer la réponse des communautés d’oiseaux au réchauffement climatique : l’augmentation au fil du temps de la valeur du CTI d’un peuplement local indique que ce peuplement contient un nombre croissant d’espèces thermophiles ou, dit autrement, que des espèces thermophiles (plus méridionales) ont remplacé des espèces qui le sont moins, ces dernières s’étant déplacées plus au nord. Les changements de CTI au cours du temps renseignent sur l’ampleur du déplacement moyen de chaque assemblage d’espèces quand les valeurs des CTI sont reportées sur les sites où les peuplements ont été relevés.
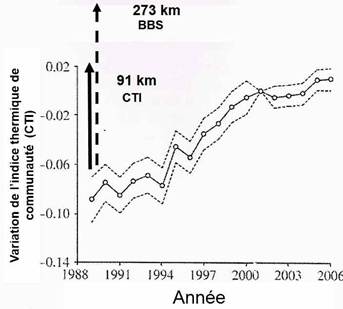
Pour de nombreuses raisons qu’il n’est pas possible de développer ici, les déplacements relevant de la traque à l’habitat sont très variables d’une espèce à l’autre de sorte que les assemblages d’espèces qui caractérisent un habitat donné changent au cours du temps. Si les déplacements en latitude des oiseaux sont régulièrement observés, la traque à l’habitat a aussi lieu en altitude quand les oiseaux remontent le long des pentes des montagnes pour suivre les variations d’altitude de leur habitat.
- Et dans les milieux extrêmes ?

3.2. Réchauffement du climat et migrations d’oiseaux : de nouveaux défis
Le déclin régulier, de l’ordre de 1% par an depuis une vingtaine d’années, des migrateurs transsahariens est dû à une série de contraintes parmi lesquelles une détérioration des conditions de migration et d’hivernage dans des habitats qui se fragmentent, se désertifient et se transforment, ainsi qu’en raison de l’aggravation des contraintes métaboliques associées à la traversée d’un Sahara qui s’élargit [12].
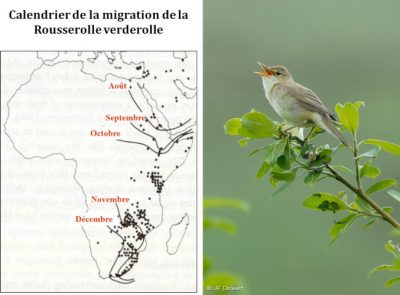
La famille des fauvettes est un bon modèle pour étudier ces questions car sur les dix-sept espèces qui nichent en Europe, certaines sont migratrices transsahariennes, d’autres migratrices partielles, d’autres étant sédentaires. Une simulation de la réponse des différentes espèces au réchauffement climatique montre que, selon les scénarios de réchauffement, les territoires de reproduction devraient remonter en moyenne de 3,8 à 4,4 degrés de latitude vers le nord, ce qui allongera de quelque 400 à 600 kilomètres les distances à parcourir pour les grands migrateurs comme la fauvette des jardins Sylvia borin car les territoires d’hivernage ne devraient pas changer de place. On a calculé que cet allongement des distances à parcourir nécessite une augmentation de la masse nette de l’oiseau de l’ordre de 9 %, correspondant au surplus de réserves énergétiques qui doivent être stockées sous forme de graisse nécessaire à ce voyage. On sait en effet qu’un petit passereau d’une quinzaine de grammes consomme à peu près 3,5 gr de graisse pour parcourir 1000 km. Ce surcoût implique donc de trouver davantage de nourriture lors des haltes migratoires et d’être en mesure de la stocker dans son corps, défi difficile à relever et cause probable du déclin constaté des populations. Il se pourrait aussi que l’adaptation aux nouvelles conditions imposées aux migrateurs ne soit pas assez rapide si les réponses génétiques aux nouvelles pressions de sélection sont moins rapides que ce que nécessite l’élévation des températures [13].

Sous l’effet des pressions actuelles de sélection, on peut s’attendre à ce que beaucoup d’espèces partiellement migratrices se sédentarisent, ce qu’on observe déjà, tandis que beaucoup de migrateurs transsahariens devront modifier leurs performances migratrices afin de répondre aux nouveaux défis qu’impose la dégradation de leurs conditions de migration. Ces variations dans l’intensité du comportement migratoire eurent lieu à maintes reprises au cours de l’histoire des oiseaux qui furent confrontés au cours du Pléistocène à l’alternance de périodes glaciaires et de périodes interglaciaires qui modifièrent considérablement le tempo et le mode des migrations.
3.3. Une alternative à la traque à l’habitat : l’adaptation locale
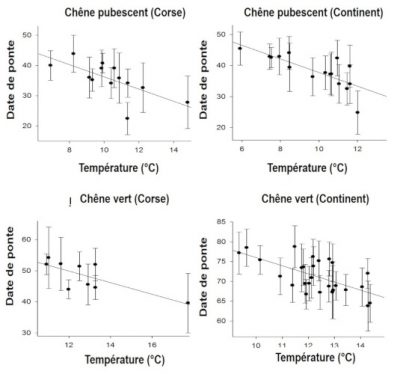
Les modifications observées des traits d’histoire de vie peuvent relever de ce qu’on appelle la plasticité phénotypique quand l’individu ajuste sa réponse à un signal de l’environnement, par exemple la température immédiate : les oiseaux ont tendance à commencer à pondre un peu plus tard quand le printemps est froid et un peu plus tôt quand il est chaud (Figure 9, [16]).
Mais cette réponse immédiate qui s’inscrit dans une « fenêtre de plasticité phénotypique » a ses limites car cette fenêtre n’est pas extensible : au-delà des limites de la fenêtre, en plus ou en moins, une maladaptation peut survenir. Dans une étude sur la variation de la date de ponte de la mésange charbonnière Parus major (Figure 10), Visser et al [17] ont été surpris de constater que la population qu’ils étudiaient ne présentait aucune réponse au réchauffement alors que le pic d’abondance des chenilles défoliatrices des chênes, nourriture presqu’exclusive de ces passereaux à la période de reproduction, avait avancé d’une dizaine de jours.
L’explication de ce défaut d’adaptation fut la suivante : pour ajuster l’époque de leur reproduction à la date optimale qui correspond au pic d’abondance des insectes dont ils se nourrissent, les oiseaux utilisent des signaux du milieu (signaux dits proximaux) qui les informent sur la quantité de nourriture dont ils disposeront plus d’un mois plus tard (après la ponte et la couvaison des œufs). Il suffit que le facteur écologique qui détermine la fenêtre de plasticité phénotypique à l’intérieur de laquelle l’oiseau prend la décision de pondre, en l’occurrence le débourrement des bouleaux, ne réponde pas de la même manière à l’augmentation de température que celui qui déclenche le développement de la nourriture des poussins, en l’occurrence le débourrement de chênes qui annonce l’éclosion des chenilles défoliatrices, pour qu’il y ait un décalage entre ces deux étapes cruciales du cycle reproducteur que sont la ponte et l’élevage des jeunes. La marge de manœuvre de l’oiseau est étroite car lorsque le premier œuf est pondu, le « coup est parti » car les événements s’enchaînent inéluctablement : il faut quatre jour pour former un œuf dans l’oviducte, l’oiseau pond un œuf par jour puis incube sa ponte pendant 12 jours. Comme les besoins des jeunes sont à leur maximum onze jours après leur éclosion, l’oiseau doit « décider » de pondre 4+10+12+11 jours = 37 jours avant le pic d’abondance de la ressource alimentaire si sa ponte est de 10 œufs. Il le fait à partir de signaux « proximaux » du milieu, en l’occurrence la photopériode [18].

Au-delà de la plasticité phénotypique qui a ses limites, une évolution adaptative par sélection directionnelle peut être très rapide de sorte que des processus sélectifs peuvent affecter significativement la dynamique d’une population en quelques générations seulement [20]. En cas de maladaptation, ce processus se chargera au cours du temps de rétablir le synchronisme rompu ; processus dit de « sauvetage évolutif » (evolutionary rescue) par lequel la structure génétique de la population change progressivement au cours du temps sous l’effet d’une sélection directionnelle qui favorise les individus les moins maladaptés.

Mais l’efficacité de la plasticité phénotypique n’a qu’un temps. Arrive un moment où la limite de la fenêtre de plasticité étant atteinte, un mécanisme microévolutif entre en jeu pour en prendre le relais, pourrait-on dire. Les méthodes de génétique quantitative qu’il a été possible d’appliquer sur cette population puisque tous les individus sont bagués, donc connus, a permis de démontrer l’efficacité de ce mécanisme à partir de deux paramètres clé, l’intensité de la sélection imposée par le différentiel de température et l’héritabilité de la date de ponte. Les auteurs de l’étude ont ainsi démontré que les mésanges dont les mères nichent un peu plus tôt les années chaudes ont de meilleurs chances de recruter leurs jeunes dans la population que les autres, les taux de recrutement se situant dans la moyenne lorsque les température de l’année précédente sont dans la moyenne.
3.4. Le coût de la maladaptation

- des jeunes de moindre qualité n’ayant que peu de chances de survie,
- un coût d’élevage des jeunes bien plus élevé (environ 2 à 4 kilojoules dépensés pour produire un gramme de poussin contre 1 à 2 kilojoules dans les nichées bien synchronisées),
- un effort métabolique fourni par les parents près de deux fois plus élevé (5 à 7 fois le métabolisme de base contre 3 à 4 fois) pour alimenter les nichées maladaptées [16].
Les conséquences d’un tel défaut de synchronisme entre offre et demande pourraient devenir graves si l’accélération du réchauffement climatique devenait telle que la réponse attendue à la sélection n’était pas assez rapide pour permettre aux organismes de s’adapter à temps aux nouvelles conditions d’environnement.
4. Changements globaux et fonctionnement de l’écosystème

En voici un exemple [22] : la multiplication par quatre des effectifs d’une population allemande de buse variable Buteo buteo (Figure 13) au cours des vingt dernières années résulte d’une amélioration de la survie de l’oiseau, passée de 0,63 à 0,74 chez les femelles et de 0,61 à 0,80 chez les mâles. De manière surprenante, ces changements de survie furent associés à une diminution considérable, au cours de la même période, des valeurs de cette métrique climatique très générale qu’est l’Oscillation de l’Atlantique Nord (NAO, températures plus froides, moins de pluie mais plus de neige ; Lire La variabilité climatique : l’exemple de l’Oscillation nord-atlantique). Bien que la relation entre la variation de la NAO et la survie des buses ne dise rien des mécanismes en jeu car corrélation ne veut pas dire causalité, ces variations furent confirmées à plus vaste échelle d’espace : quand la NAO décroit, la survie des buses augmente et vice versa. Le mécanisme impliqué est donc d’une manière ou d’une autre lié à ces facteurs climatiques.
Les auteurs de l’étude finirent par le découvrir : la proie principale des buses, surtout en hiver, est le campagnol des champs Microtus arvalis dont les populations sont sensibles au climat. Alors que la pluie et le gel sont très défavorables à ce petit mammifère, un couvert de neige les protège tout en permettant au prédateur de les détecter et de les capturer si le manteau neigeux n’est pas trop épais. Une petite couche de neige, très fréquente au cours des deux dernières décennies, est donc très favorable aux campagnols, donc à leurs prédateurs. Les rapports étroits observés entre la variation géographique de la survie des buses et celle des conditions climatiques est une démonstration de l’interdépendance des différents niveaux de variation, celui du climat, celui des campagnols et celui de leurs prédateurs. Mais cet exemple illustre aussi la complexité et, souvent, l’aspect inattendu des relations que des modifications du climat peuvent entraîner. D’où la très grande difficulté à prévoir et modéliser les changements attendus de la réorganisation des réseaux trophiques au sein des assemblages d’espèces et, d’une manière plus générale, les réponses que les organismes apportent aux dérèglements du climat.
5. Pour aller plus loin
Les limites de la plupart des études sur les réponses des organismes aux dérèglements climatiques tiennent à leur nature essentiellement corrélative qui ne dit rien des facteurs déclenchants et des mécanismes mis en jeu. Or l’implication de plusieurs composantes du changement global dans les modifications d’aires de distribution ou d’évènements phénologiques comme les dates de ponte ou départs en migration chez les oiseaux complique l’analyse des mécanismes. Trois types d’approches peuvent apporter d’intéressantes réponses :
- La première est la modélisation des enveloppes de niche [23] qui est fondée sur une représentation statistique multivariée de la niche de l’organisme réalisée en mettant en relation sa distribution spatiale avec des variables clé de l’environnement. La niche ainsi définie est projetée dans l’espace géographique que l’espèce devrait occuper dans le futur en fonction de différents scénarios attendus de variation du climat tels que proposés par le GIEC (Groupe d’Experts Intergouvernemental sur l’Évolution du Climat).
- Une deuxième approche dont les enjeux sont particulièrement prometteurs relève de l’épigénétique, à savoir l’étude des mécanismes d’origine environnementale (stress climatique, perturbation, environnement maternel) qui modulent l’expression de gènes codants sans modifier la structure génétique de l’organisme (Lire L’épigénétique, le génome et son environnement). Ces mécanismes d’hérédité non mendélienne peuvent jouer un rôle considérable dans l’adaptation à des changements d’environnement car ils s’expriment lors du développement de l’individu sans passer par le crible intergénérationnel de la sélection naturelle. Ces changements d’origine épigénétique qui, de plus, sont héritables, ont comme conséquence évolutive soit de déplacer la moyenne du trait vers un nouvel optimum, soit de modifier sa variance donc sa fitness, soit de diminuer sa variance autour d’un nouvel optimum, ce qu’on appelle un processus de « canalisation phénotypique » [24].
- Une troisième approche, encore sous-exploitée mais prometteuse, est l’utilisation de données du passé. Dès lors qu’on peut les identifier, les réponses apportées par les organismes à des changements qui eurent lieu dans un passé plus ou moins lointain représentent des « expériences naturelles » qui permettent de tester des théories écologiques et évolutives [25].
Le registre fossile peut ainsi apporter des réponses sur l’évolution adaptative en réponse au changement climatique à des échelles de temps de quelques années à une dizaine de milliers d’années. Il apporte aussi des réponses sur la réalité d’une plasticité phénotypique à des échelles de temps plus courtes, de l’ordre d’une à un millier d’années. La paléogénomique permet aussi d’identifier les déplacements d’aires de distribution, des effondrements de populations et des événements d’extinction en réponse à des changements de climat. Les réponses à des climats variables ont ainsi été explorées à partir de la génétique évolutive et d’approches expérimentales « d’écologie de la résurrection » qui consistent à réanimer des propagules en dormance prolongée, parfois depuis plusieurs siècles (diatomées, insectes, algues champignons, bactéries) puis à les soumettre expérimentalement à des événements de stress climatique [26]. Le gros mérite de toutes ces approches dont plusieurs sont encore au stade exploratoire est de permettre de passer de modèles corrélatifs à des modèles-processus permettant l’identification des mécanismes en jeu.
6. Messages à retenir
- Les organismes sont adaptés à vivre à l’intérieur d’une fenêtre de température en deçà ou au-delà de laquelle leur survie est compromise,
- La « traque à l’habitat » en réponse au réchauffement est une réponse classique mais variable selon les espèces,
- La traque à l’habitat n’est plus possible dans les habitats extrêmes (toundra, haute montagne), d’où les menaces qui pèsent sur les oiseaux de ces milieux,
- Le réchauffement du climat impose de nouvelles et sévères contraintes aux migrateurs transsahariens,
- Une alternative à la traque à l’habitat: l’adaptation locale par ajustement ou microévolution,
- Les changements globaux modifient les interactions entre espèces, donc la structure et la dynamique des peuplements.
Notes et références
Image de couverture. [Source : schéma Jacques Blondel].
[1] Les changements infligés par les humains au système Terre se sont avérés si profonds et universellement répartis, que le météorologue et chimiste Paul Josef Crutzen forgea à la fin du XXe siècle le terme d’Anthropocène (Crutzen & Stoermer 2000 ; The « Anthropocene ». Global Change Newsletter 41, 12-13), littéralement, « l’ère de l’homme » pour désigner cette époque de l’histoire de la Terre à partir de laquelle les activités humaines ont irrémédiablement marqué l’écorce terrestre, au même titre que de puissantes forces telluriques. Bien que la Commission internationale de stratigraphie ait accueilli avec réserve cette nouvelle séquence de l’histoire de la Terre, le terme fit rapidement partie du vocabulaire scientifique, y compris de celui des sciences de la vie.
[2] Parmesan, C. 2006. Ecological and evolutionary responses to recent climate change. Annu. Rev. Ecol. Syst 37: 637-669.
[3] Pearce-Higgins, J. W. & Green, R. 2014. Birds and climate change. Impacts and conservation responses. Cambridge, Cambridge Univ. Press.
[4] Sekercioglu, C. H., Schneider, S. H., Fay, J. P. & Loarie, S. R. 2008. Climate change, elevational range shifts, and bird extinctions. Cons. Biol. 22: 140-150.
[5] Brown, J. H., Gillooly, J. F., Allen, A. P., Savage, V. M. & West, G. B. 2004. Toward a metabolic theory of ecology. Ecology 85: 1771-1789.
[6] Hewitt, G. M. 2004. Genetic consequences of climatic oscillations in the Quaternary. Phil. Trans. R. Soc Lond. B 359: 183-195.
[7] Devictor, V., Julliard, R., Couvet, D. & Jiguet, F. 2008. Birds are tracking climate warming but not fast enough. Proc. R. Soc. Lond. B 275: 2743-2748.
[8] Devictor, V., van Swaay, C. Brereton, T. Brotons, L. Chamberlain, D. Heliölä, J. Herrando, S. Julliard, R. Kuussaari, M. Lindström, Å. Reif, J. Roy, D.B. Schweiger, O. Settele, J. Stefanescu, C. Van Strien, A. Van Turnhout, C. Vermouzek, Z. WallisDeVries, M. Wynhoff, I. & Jiguet, F. (2012) Differences in the climatic debts of birds and butterflies at a continental scale. Nature Climate Change. 2, 121–124.
[9] Burton, J. F. 1995. Birds and Climate Change. London, Christopher Helm.
[10] Devictor, V., Julliard, R., Couvet, D. & Jiguet, F. (2007) French birds lag behind climate warming. Nature Proceedings 10 p. DOI: 10.1038/npre.2007.1275.
[11] Piersma, T. 2007. Using the power of comparison to explain habitat use and migration strategies of shorebirds worldwide. J. Ornithol. 148: S45-S59.
[12] Berthold, P., Fiedler, W., Schlenker, R. & Querner, U. 1998. 25-year study of the population development of Central European songbirds: a general decline, most evident in long-distance migrants. Die Naturwissenschaften. 85: 350-353.
[13] Doswald, N., Willis, S. G., Collingham, Y. C., Pain, D. J., Green, R. E. & Huntley, B. 2009. Potential impacts of climate change on the breeding and non-breeding ranges and migration distance of European Sylvia warblers. J. Biogeogr. 36: 1194-1208.
[14] Berthold, P. 1991. Genetic control of migratory behaviour in birds. Trends Ecol. Evol. 6: 254-257.
[15] Crick, H. Q. P., Dudley, C., Glue, D. E. & Thomson, D. L. 1997. UK birds are laying eggs earlier. Nature 338: 526.
[16] Thomas D. W., Blondel J., Perret P., Lambrechts M. M. & Speakman J. R. 2001. Energetic and fitness costs of mismatching resource supply and demand in seasonally breeding birds. Science 291: 2598-2600.
[17] Visser, M. E., Adriaensen, F., van Balen, J. H., Blondel, J., Dhondt, A. A., van Dongen, S., du Feu, C., Ivankina, E. V., Kerimov, A. B., de Laet, J., Matthysen, E., McCleery, R., Orell, M. & Thomson, D. L. 2003. Variable responses to large-scale climate change in European Parus populations. Proceedings of the Royal Society of London, series B 270: 367-372.
[18] Lambrechts, M. M., Blondel, J., Maistre, M. & Perret, P. 1997. A single response mechanism is responsible for evolutionary adaptive variation in a bird’s laying date. Proc. Natl. Acad. Sci. USA. 94: 5153-5155.
[19] Both, C. & Visser, M. E. 2001. Adjustment to climate change is constrained by arrival date in a long distance migrant bird. Nature 411: 296-298.
[20] Gingerich, P.D. 2009. Rates of evolution. Annu. Rev. Ecol. Evol. System 40: 657-75.
[21] Charmantier, A., McCleery, R. H., Cole, L. R., Perrins, C. M., Kruuk, L. E. B. & Sheldon, B. C. 2008. Adaptive phenotypic plasticity in response to climate change in a wild bird population. Science 320: 800-803.
[22] Jonker, R. M., Chakarov, N. & Krüger, O. 2014. Climate change and habitat heterogeneity drive a population increase in Common Buzzards Buteo buteo through effets on survival. Ibis 156 : 97-106.
[23] Lavergne, S., Mouquet, S., Thuiller, W. & Ronce, O. 2010. Biodiversity and climate change: Integrating evolutionary and ecological responses of species and communities. Annu. Rev. Ecol. Evol. Syst. 41: 321-350.
[24] Rey, O., Danchin, E., Mirouze, M., Lootù, C. & Blanchet, S. 2016. Adaptation to global change: a Transposable Element-Epigenetics perspective. Trends Ecol. Evol. 31: 514-526.
[25] Nogues-Bravo, D., Rodriguez-Sanchez, F., Orsini, L., de Boer, E., Jansson, R., Morlon, H., Fordham, D. A. & Jackson, S. T. 2018. Cracking the code of biodiversity responses to past climate change. Trends Ecol. Evol. 33: 765-767.
[26] Orsini, L., Schwenk, K., De Meester, L., Colbourne, J.K., Pfrender, M.E. & Weider, L.J. 2013. The evolutionary time machine: using dormant propagules to forecast how populations can adapt to changing environments. Trends Ecol. Evol. 28: 274-282.
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : BLONDEL Jacques (25 août 2019), Comment les oiseaux s’adaptent-ils à un climat qui change ?, Encyclopédie de l’Environnement. Consulté le 15 février 2026 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/vivant/comment-oiseaux-sadaptent-climat-qui-change/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.







