Air humide et condensation
PDFLa première étude documentée sur l’air humide semble être la description faite par Charles Leroy (1751), un médecin de Montpellier (France). Il explique en 1751 à l’Académie Royale des Sciences que l’eau peut être dissoute dans l’air en fonction de la température de l’air, la température la plus élevée correspondant à une plus grande dissolution. Pour étayer son affirmation, il décrit plusieurs expériences. La plus démonstrative concerne une bouteille d’air fermée à la température de la journée. Une fois refroidi la nuit, l’air devient incapable de retenir toute l’eau dissoute à la température plus élevée de la journée : l’excès d’eau conduit à la formation de gouttelettes condensées bien visibles à l’intérieur de la bouteille.
En effet, l’air n’est jamais complètement sec ; il contient toujours, de manière invisible, de la vapeur d’eau dont la concentration varie en fonction de sa température. Outre la vapeur, l’air humide peut également contenir de l’eau à l’état condensé visible : liquide (gouttelettes de brouillard), solide (brouillard givré). Dans ces derniers cas, où phases vapeur et condensée coexistent, l’air humide est dit sursaturé.
On peut donc considérer que l’air humide est formé (1) d’air sec peu susceptible de se condenser dans les conditions de température et de pression considérées ici, et (2) de vapeur d’eau susceptible de se condenser en liquide ou en glace. L’air sec est principalement composé d’azote (≈ 78%) et d’oxygène (≈ 21%). Pour des conditions usuelles de température et de pression rencontrées à la surface de la terre, les deux gaz sont loin de leurs coordonnées de point critique et les deux fluides peuvent être acceptés comme des gaz parfaits. L’air sera donc considéré comme un seul gaz parfait. L’eau est également loin de ses coordonnées de point critique et peut être également considérée comme un gaz parfait.
1. Pressions partielles : la loi de Dalton
La pression partielle d’un gaz est la pression qu’aurait le gaz s’il était seul dans un volume V. L’air sec et l’eau étant tous deux des gaz idéaux, la pression totale est égale à la somme des pressions partielles : C’est la loi de Dalton. Avec pa (resp pv) la pression partielle de l’air (resp. de l’eau) et pm la pression totale, on obtient pm = pa + pv. Cette règle d’additivité correspond à négliger les forces intermoléculaires entre les molécules de gaz. La pression étant due aux impacts des molécules de gaz en mouvement, la pression totale est simplement l’addition des impacts de chaque type de molécules.
2. Équation d’état
L’équation d’état de l’air sec et de la vapeur d’eau est l’équation du gaz parfait piV=niRT où l’indice i représente l’air (i=a) ou la vapeur d’eau (i=v) ; ni = mi /Mi est le nombre de moles (i) de masse molaire Mi et de masse mi dans un volume V, R = 8,314 J.mole-1.K-1 est la constante molaire des gaz. Les propriétés de l’air humide à une pression partielle donnée de la vapeur d’eau peuvent être déduites de cette simple équation d’état.
3. Saturation ; condensation
Considérons le processus de refroidissement à pression constante pm d’une masse d’air humide qui contient une masse donnée d’eau. La conservation de la masse exige que la masse totale et la masse de vapeur d’eau restent constantes au cours du processus. Il en va donc de même pour le nombre de moles de vapeur d’eau et la fraction molaire correspondante nv / n = pv / pm (d’après l’équation des gaz parfaits ci-dessus et n = na +nv). Il en résulte que la pression de la vapeur d’eau reste constante pendant le processus de refroidissement. Dans l’atmosphère, le refroidissement de l’air humide se produit donc à pression de vapeur d’eau constante.
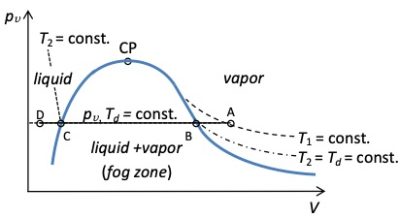
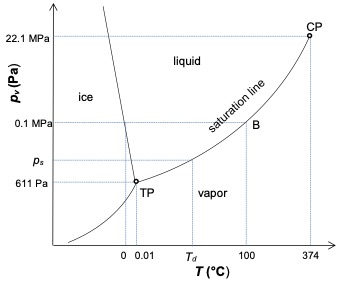
L’air humide peut être saturé (point B de la figure 1) ou sursaturé, lorsque des gouttelettes de liquide (brouillard) sont présentes (ligne BC de la figure 1).
La pression de vapeur saturée peut alors être atteinte dans un air humide donné de deux manières. (i) En refroidissant une masse donnée d’air humide : la pression de vapeur reste constante à pv mais ps diminue jusqu’à ce que l’égalité pv= ps(Td) soit satisfaite. (ii) Ajout d’une masse d’eau à un volume donné d’air humide à température constante : la pression de vapeur augmente jusqu’à atteindre à la même température pv= ps. Si on ajoute plus d’eau à température constante, on obtient la coexistence de la pression de vapeur saturée et du liquide. L’air humide est alors sursaturé.
De ce qui précède, on peut définir l’humidité relative RH comme le rapport, à une température donnée, entre la pression de vapeur et la pression de vapeur saturante, RH = pv(T)/ps(T). Lorsqu’on refroidit une masse donnée d’air humide, RH augmente pour atteindre 100% à la ligne de saturation. Lorsqu’on ajoute de l’eau à température constante, RH augmente également jusqu’à 100% et atteint la ligne de saturation. L’humidité relative est un indice courant pour déterminer à quel point un air humide donné est proche de la saturation. Plus l’humidité relative est élevée, plus le refroidissement ou la masse ajoutée nécessaire pour obtenir la condensation est faible.
Notes
Image de couverture. [Source : libre de droits]
Beysens, D. (2018). Dew water. Gistrup : Rivers Publisher.
Beysens, D. (2022). The Physics of Dew, Breath Figures and Dropwise Condensation. Berlin: Springer Verlag.
Mylymuk-Melnytchouk, I., Beysens, D. (2016). Puits aériens : mythes et réalités ou Travaux russes & soviétiques sur la production d’eau à partir de l’air. Sarrebruck : Editions Universitaires Européennes.
BEYSENS, D., MILIMOUK-MELNYTCHOUK, I., MUSELLI, M. (2009). Condenseurs radiatifs de rosée. Techniques de l’Ingénieur, base documentaire » Génie énergétique « , IN101- 04, 1-10.
MYLYMUK, I., BEYSENS, D. (2005). A la Poursuite des Fontaines Aériennes ou Les Incroyables Aventures de Français en Ukraine. Sofia-Antipolis : Book-eBook.
OPUR. Disponible sur www.opur.fr




