Améliorer la photosynthèse ?
PDFDifférentes approches génétiques ont été et sont envisagées pour améliorer les capacités du métabolisme photosynthétique des plantes cultivées C3 en vue de les adapter aux variations climatiques futures. Il existe également des travaux menant à des applications industrielles, comme la recherche de nouvelles sources d’énergie et de nouveaux bioproduits et biomatériaux.
1. Introduction de voies bactériennes de recyclage des produits de la photorespiration chez les plantes supérieures

2. Est-il possible de créer de nouvelles voies métaboliques permettant de fixer et métaboliser plus efficacement le carbone du CO2 ?
L’amélioration des performances de la RubisCO par voie chimique par des produits inhibiteurs de la fonction oxygénase de l’enzyme et par voie génétique ayant échoué, des chercheurs germano-suisses (institut Max-Planck) et américains de l’équipe de Thomas Schwander ont tenté d’améliorer le système de carboxylation. Ils ont ainsi recherché et sélectionné les carboxylases les plus actives du règne vivant et, en les modifiant si besoin était par génie génétique, en ont accru les performances. [2] Ces « nouvelles carboxylases artificielles », accompagnées des enzymes associées à leur fonctionnement, replacées dans des milieux biologiques adéquats, ont montré des activités 5 à 20 fois supérieures à celles présentent dans les chaines métaboliques « naturelles ». Ces chercheurs ont créé ainsi une voie de carboxylation nouvelle qui a été dénommée « cycle CETCH » par les équipes de chercheurs, du nom de la chaine d’enzymes qui la compose. [3] Ils ont observé que cette voie nouvelle fonctionnait in vitro dans des cellules bactériennes non photosynthétiques, tout en consommant moins de molécules énergétiques (NADPH et ATP) pour leur fonctionnement que la voie photosynthétique naturelle RubisCO /cycle de Benson, Bassham et Calvin. Reste à introduire ce cycle dans des cellules vertes photosynthétiques.
3. Le système C4 peut-il être introduit chez les plantes C3 ? Le cas du riz

Si les entreprises de transformations génétiques de plantes C3 en plantes C4 ne sont pas aisées, les chercheurs ne désespèrent pas de réussir, d’autant plus que l’on sait que le système C4 est apparu plusieurs fois au cours de l’évolution dans certaines familles de plantes comme les amarantacées par exemple. C’est un énorme défi. De grands consortiums de biologie végétale (IRRI, Institut international du riz) sont engagés dans cette recherche, car le riz est une des plantes les plus consommées directement par les humains. [4]
4. Production d’hydrogène par les microalgues
Dans certaines conditions expérimentales, chez les microalgues et les cyanobactéries, une partie des électrons et des protons, issus de l’oxydation de l’eau au cours de la photosynthèse, en absence d’oxygène, n’est plus utilisée pour réduire les composés carbonés mais détournée pour synthétiser de l’hydrogène. Le CEA par exemple (sites de Grenoble, Cadarache et Saclay) s’est intéressé particulièrement à la photosynthèse comme source d’énergie, avec un intérêt particulier pour la production de « photobiohydrogène » par les micro-algues. [5] Cette approche a donné des résultats encourageants mais de nombreux progrès techniques sont encore à réaliser pour rendre efficace et économiquement rentable ce système de bio-production d’hydrogène.
5. La feuille artificielle ou bionique
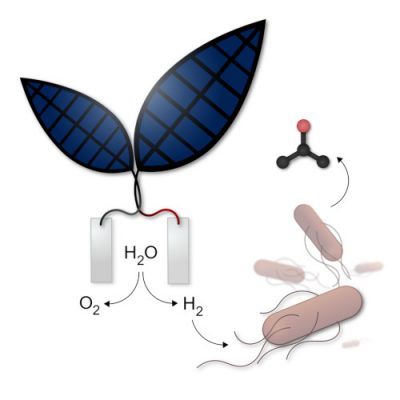
Un premier type de « feuille artificielle », composée d’un assemblage de fines couches de différents métaux, produit du dioxygène et du dihydrogène, ce dernier pouvant être utilisé pour faire fonctionner une pile à combustible et donc produire de l’électricité. Le professeur Nocera, chercheur de l’université d’Harvard, aux États-Unis, a annoncé que la nouvelle feuille artificielle pourrait réaliser une photosynthèse dix fois plus efficace que le processus naturel de photosynthèse (Figure 4). [6] Le système serait suffisamment abouti pour envisager des applications commerciales.
MS Strano, du MIT (Massachusetts Institute of Technology) et ses collaborateurs ont inséré des nanoparticules d’oxyde de cérium dans les chloroplastes isolés afin de de piéger les radicaux libres de l’oxygène lors d’un stress oxydatif (fort éclairement par exemple) et de prolonger le processus photosynthétique dans les meilleures conditions d’activité. Dans la même optique, M. Strano et ses collaborateurs ont également introduit des nanotubes de carbone (photo-absorbeurs prosthétiques puissants) recouverts d’ADN, chargés négativement dans les chloroplastes isolés. [7] Cette technique augmente l’étendue du spectre de longueur d’ondes perceptible par les chloroplastes qui absorbent ainsi près de 50% de rayonnement lumineux supplémentaire, de l’ultraviolet à l’infrarouge proche, par rapport aux chloroplastes isolés dépourvus de cette technologie. De plus, ces chercheurs ont démontré que les nanotubes présents dans les chloroplastes détectent et séquestrent aussi le monoxyde d’azote NO, un des gaz les plus impliqués dans la pollution atmosphérique. Les chercheurs ont reproduit ces expériences sur plante entière, Arabidopsis thaliana notamment.
Notes et références
[1] Maurino V.G. & Peterhansel C. (2010) Photorespiration: current status and approaches for metabolic engineering. Cur. Op. Plant Biol.13(3):248–255 ; Ort D.R., Merchant S.S., et al. (2015). Redesigning photosynthesis to sustainably meet global food and bioenergy demand. Proc. Natl. Acad. Sci. U.S.A. (28):8529-8533.
[2] Schwander T., von Borzyskowski L.S., Burgener S., Cortina N.S. & Erb T.J.2016. A synthetic pathway for the fixation of carbon dioxide in vitro. Science 354:900-904.
[3] CETCH : crotonyle-CoA/éthylmalonyle-CoA/hydroxybutyryle-CoA
[4] von Caemmerer S., Quick W.P. & Furbank R.T. (2012). Development of C4 Rice: Current Progress and Future Challenges. Science 336:1671-1672.
[5] Desplats, C., Mus F., Cuine S., Billon E., Cournac L., & Peltier G. (2009). Characterization of Nda2, a Plastoquinone-reducing Type II NAD(P)H Dehydrogenase in Chlamydomonas chloroplasts. J. Biol. Chem. 284(7):4148-57.
[6] Liu C., Colón B.C., Ziesack M., Silver P.A. & Nocera D.G. (2016). Water splitting–biosynthetic system with CO2 reduction efficiencies exceeding photosynthesis. Science 352:1210-1213.
[7] Giraldo JP, Landry MP, Faltermeier SM, McNicholas TP, Iverson NM, Boghossian AA, Reuel NF, Hilmer AJ, Sen F, Brew JA & Strano MS (2014).Plant nanobionics approach to augment photosynthesis and biochemical sensing. Nature Materials 13:400–408.




