Le chemin du carbone dans la photosynthèse
PDF
Comment le carbone du dioxyde de carbone -le CO2– présent dans l’atmosphère est-il intégré dans la matière organique constitutive du vivant, la biomasse ? Depuis plusieurs milliards d’années, ce processus se réalise lors des étapes biochimiques de la photosynthèse grâce à des organismes utilisant l’énergie récupérée par la chlorophylle à partir de la lumière solaire. Cependant, la photosynthèse a dû adapter ces mécanismes pour survivre aux différents changements environnementaux qui se sont succédé à l’échelle des temps géologiques. L’accumulation –dans l’atmosphère- du dioxygène (O2) produit lors des étapes photochimiques de la photosynthèse (Lire Lumière sur la photosynthèse) a été un de ces évènements majeurs. Différentes stratégies originales ont été retenues au cours de l’évolution et permis ainsi de produire une immense biodiversité de biomolécules organiques dont nous bénéficions tant pour nous nourrir que pour nous chauffer, nous habiller, nous loger et nous soigner.
- 1. Qu’est-ce que la photosynthèse ?
- 2. Comment les plantes fixent-elles le carbone du CO2 ?
- 3. La production d’oxygène au cours des temps géologiques
- 4. L’oxygène, une catastrophe pour la photosynthèse ?
- 5. Concentrer le CO2 au voisinage de la RubisCO
- 6. La photosynthèse dans un environnement changeant
- 7. Messages à retenir
1. Qu’est-ce que la photosynthèse ?
1.1. Fabriquer de la biomasse à partir du CO2 de l’air
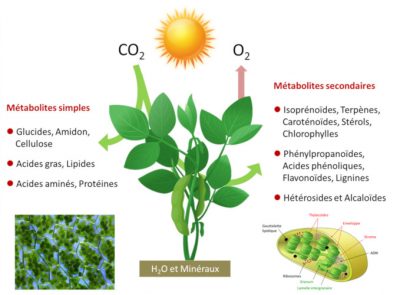
Les organismes photosynthétiques sont de ce fait photoautotrophes*. La photosynthèse est à l’origine de la plus grande partie des molécules de la chaine alimentaire des êtres vivants et de la majorité de la biomasse organique de notre Planète. La photosynthèse se réalise dans les chloroplastes, organites intracellulaires verts de quelques micromètres qui renferment la machinerie photosynthétique (Lire Lumière sur la photosynthèse).
L’équation simplifiée de la photosynthèse peut s’écrire simplement comme suit :
CO2 + H2O + énergie de la lumière → molécules carbonées riches en énergie + O2
La photosynthèse fixe ainsi chaque année de 115 à 120 milliards de tonnes (ou Gigatonnes) de carbone à partir du CO2 de l’air, dont 60 pour les continents. Pour y parvenir, les végétaux utilisent une toute petite partie (environ 1 à 2%) de l’énergie solaire qui arrive sur notre planète. A l’échelle du globe c’est une puissance avoisinant 130-140 térawatts (1 terawatt = 1012 watts), qui est utilisée, ce qui équivaut à environ six fois la consommation énergétique de l’humanité. Comment les organismes photosynthétiques réalisent-ils cela ?
1.2. La photosynthèse se décline en deux phases
- une phase photochimique très rapide qui se déroule dans le système membranaire des chloroplastes, les thylacoïdes (Figures 1 & 2).
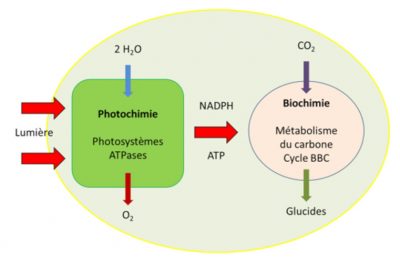
- Une phase métabolique plus lente que la précédente qui se déroule dans le liquide intérieur des chloroplastes, le stroma (Figure 2).
Les mécanismes biochimiques impliqués dans la fixation du carbone du CO2 de l’air, nécessitent la présence d’un récepteur carboné, d’une enzyme qui assure cette fixation ou plus exactement cette carboxylation, donnant naissance à des composés organiques. Ce métabolisme du carbone de la photosynthèse est connu sous le terme de Cycle de Benson-Bassham-Calvin.
Cet article est focalisé essentiellement sur la description :
- des mécanismes biochimiques de la photosynthèse responsables de la fixation du carbone du dioxyde de carbone présent dans l’atmosphère ;
- de leur évolution au cours des changements de l’environnement ;
- l’impact de l’apparition d’oxygène dans l’atmosphère au cours des différentes périodes géologiques.
2. Comment les plantes fixent-elles le carbone du CO2 ?
2.1. Un peu d’histoire
Jean Sénebier (lire Focus Quelques pionniers de la photosynthèse) a été le premier scientifique à avoir affirmé dès 1782 « que le gaz carbonique CO2 est fixé à la lumière par les organismes photosynthétiques et représente une nourriture pour la plante ». De la fin du 18e siècle jusqu’au milieu des années 1940, la nature des voies d’assimilation photosynthétique du carbone provenant du dioxyde de carbone (CO2) est restée un mystère. Il a été tout d’abord supposé, au début du 19e siècle, par J.B. Boussingault et F. Bayer, que les glucides pouvaient résulter de l’union du carbone avec les éléments de l’eau, d’où le premier nom d’hydrates de carbone attribué aux glucides. La plupart des formules représentant les glucides peuvent en effet s’inscrire comme s’ils étaient le résultat de la polymérisation de cette molécule fondamentale renfermant du carbone et de l’eau : (CH2O)n. Par la suite, plusieurs autres composés ont été évoqués comme premiers produits de la photosynthèse. Il s’agit par exemple de l’acide carbonique H2CO3, de l’acide formique HCOOH, le plus simple des acides carboxyliques*, etc. Toutefois, aucun résultat expérimental n’est venu confirmer ces hypothèses. Si l’hypothèse de l’acide formique s’est maintenue très longtemps dans les ouvrages comme premier produit de la photosynthèse, elle ne le doit qu’à sa désarmante simplicité.
2.2. Le Cycle de Benson-Bassham-Calvin
- Recherche de l’accepteur de CO2 et découverte d’une carboxylase spécifique
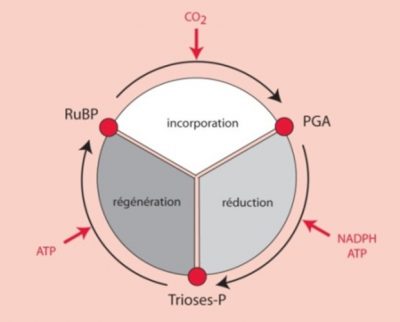
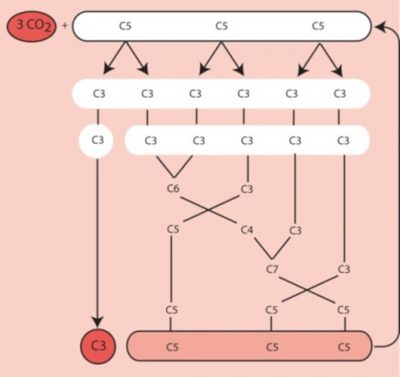
C’est en utilisant le 14CO2 comme traceur radioactif que Benson [2] a observé que le carbone du 14CO2, se fixe sur une structure carbonée préexistante plus complexe : un composé phosphorylé à cinq carbones, le ribulose-1,5-bisphosphate ou RuBP (lire Focus Décryptage du Cycle de Benson-Bassham-Calvin). [3] Ce composé présente une structure chimique favorable à l’ajout d’un carbone (ou carboxylation). Cette réaction aboutit à la formation d’un composé à six carbones peu stable, métabolisé immédiatement en deux molécules à trois carbones (C3), l’acide phosphoglycérique, le PGA en anglais [4] (Figure 3).
L’enzyme qui assure la fixation du carbone du CO2 sur le RuBP est une carboxylase*, la RuBP carboxylase, dénommée par la suite RubisCO (voir plus loin). Cette enzyme spécifique de la photosynthèse est la porte d’entrée du carbone dans la majorité des molécules organiques de la Planète depuis plus de trois milliards d’années (Lire Focus La RubisCO).
La RubisCO, enzyme complexe de poids moléculaire élevé (550 kDa) [5], est localisée dans le stroma des chloroplastes où elle représente 30 à 50% des protéines solubles. Enzyme la plus importante quantitativement de la biosphère, la RubisCO constitue ainsi la principale réserve d’azote organique des feuilles [6]. A cause de son rôle central dans l’autotrophie, on considère que la présence sur Terre de chaque humain a nécessité la formation de 5 kg de RubisCO.
- Réduction de l’acide phosphoglycérique en triose-phosphates
- Devenir des trioses phosphates
Pour six molécules de trioses phosphates synthétisées, une seule est destinée à la synthèse de glucides, d’acides aminés, de lipides, etc. Les cinq autres molécules de trioses phosphates sont utilisées pour régénérer le RuBP, l’accepteur de CO2 (Figure 4). La régénération d’une molécule de RuBP a un cout énergétique élevé qui nécessite 2 NADPH et 3 ATP par molécule mais cette énergie est fournie gratuitement par le Soleil.
Les premiers produits de ce cycle étant des molécules à trois carbones, les plantes utilisant ce cycle ont été dénommées plantes à photosynthèse de type C3.
Les trioses phosphates non utilisés pour le recyclage du RuBP sont utilisés dans le chloroplaste pour la synthèse d’amidon, d’acides aminés ou de lipides ou exportés hors du chloroplaste et transformés en sucres par les enzymes du cytoplasme (Lire Focus Saccharose ou amidon ?).
- Synthèse et transport des assimilats photosynthétiques
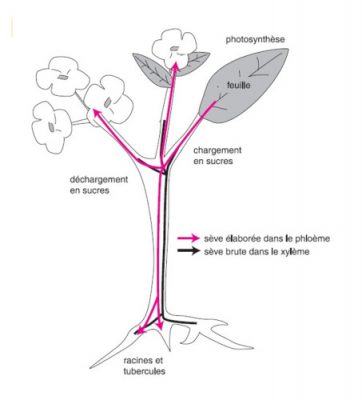
- Vidéo : La plante en kit, épisode 1 : La feuille. Avec Marc André-Selosse par Ver de Terre Production (Licence Creative Commons CC0).
2.3. Et la température ?
La température affecte différemment les processus biophysiques et les processus métaboliques. Les processus biophysiques comme l’absorption de la lumière par les pigments chlorophylliens et la formation de NADPH et d’ATP sont peu sensibles aux variations de température. En revanche, les réactions biochimiques à l’origine de la fixation de CO2 et d’O2 et de la synthèse des sucres, de même que les échanges de molécules entre compartiments cellulaires et organes en dépendent fortement. En moyenne, une hausse de10°C double la vitesse des réactions biochimiques.
Dans les régions tempérées, la température de l’air et des végétaux est sujette à de fortes variations saisonnières et journalières qui sont parallèles à la quantité d’énergie solaire arrivant à la surface du sol. Les plantes peuvent, à des degrés divers, s’adapter à des variations journalières rapides de température, entre matin et fin de journée par exemple. Les changements rapides de la température des feuilles suivent habituellement les variations de l’ensoleillement. Dans les milieux caractérisés par des températures basses, comme le milieu alpin, les plantes ont développé des mécanismes qui leur permettent de faire face à ces variations de températures (Lire Comment les plantes supportent les stress alpins ?).
Les plantes peuvent également s’acclimater à des changements de température de longue durée. Dans tous les cas la température à laquelle on observe le maximum d’activité photosynthétique suit la température de croissance. L’acclimatation à de nouvelles conditions thermiques peut provoquer néanmoins chez certaines plantes une baisse de la photosynthèse.
3. La production d’oxygène au cours des temps géologiques
Les premières réactions photosynthétiques sont apparues il y a plus de trois milliards d’années quand l’atmosphère était quasiment dépourvue de dioxygène O2 mais composée essentiellement d’eau (H2O), de dioxyde de carbone CO2 (10 à 15%), de dioxyde d’azote (N2), et d’hydrogène sulfuré (H2S). A cette époque, lors de la transformation de l’énergie de la lumière en molécules énergétiques, les bactéries photosynthétiques primitives -les bactéries pourpres sulfureuses comme les bactéries vertes sulfureuses- oxydaient l’hydrogène sulfuré. La photosynthèse était de type anoxygénique.
Avec l’apparition des ancêtres des cyanobactéries, H2O est devenu le substrat quasiment inépuisable d’oxydation et le pourvoyeur d’électrons et de protons avec libération d’oxygène dans l’atmosphère. La photosynthèse est devenue de type oxygénique (Lire Lumière sur la Photosynthèse). Actuellement ces deux types de photosynthèse coexistent :
CO2 + 2 H2S → (CH2O) + H2O + 2 S (Photosynthèse anoxygénique)
CO2 + 2 H2O → (CH2O) + H2O + O2 (Photosynthèse oxygénique)
Après l’apparition, il y a environ 2,5 milliards d’années, de la photosynthèse oxygénique source d’oxygène, la concentration en O2 dans l’atmosphère est restée pendant une longue période très faible en raison de la forte capacité des minéraux à piéger l’oxygène sous forme d’oxyde de fer (Fe2O3). Cette phase dans l’histoire de la Terre est clairement marquée dans des couches géologiques rouges riches en ce composé ferrique (Lire La biosphère, acteur géologique majeur). Après saturation des minéraux en oxygène, c’est-à-dire après la période de la « grande oxydation » il y a 2,4 milliards d’années environ, l’oxygène libéré par l’activité photosynthétique des cyanobactéries et des eucaryotes s’est alors répandu dans l’atmosphère. S’élevant à des concentrations proches de 21% de la concentration gazeuse de l’atmosphère, la teneur en dioxygène est devenue un handicap sérieux pour les espèces photosynthétiques.
4. L’oxygène, une catastrophe pour la photosynthèse ?
4.1. Encore un peu d’histoire
Dans les années 1920, Otto Warburg [7] observe que si on abaisse de 20 à 2% la teneur en dioxygène O2 de l’air (contenant actuellement 0,0408% de CO2)[8], la vitesse d’assimilation nette du CO2 est multipliée par un facteur de 1,5 à 2. C’est l’effet Warburg : les fortes tensions d’oxygène inhibent sous éclairement la prise de carbone. Dans les années 1970, suite à des expériences de marquage à l’aide d’isotope de l’oxygène 18O2, Bowes, Lorimer, Ogren et Tolbert montrent que la ribulose biphosphate carboxylase, l’enzyme qui fixe le dioxyde de carbone, est capable également de fixer le dioxygène. [9]
4.2. Dilemme de la RubisCO : la compétition O2/CO2
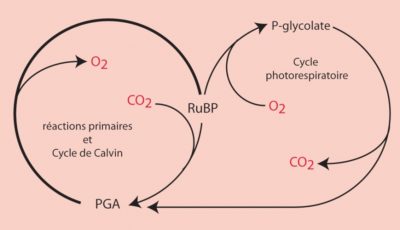
- le dioxyde de carbone CO2 favorise la fonction carboxylase de la RubisCO ;
- le dioxygène O2 favorise la fonction oxygénase manifestée par un processus appelé photorespiration.
En présence d’une concentration élevée de CO2, la RubisCO fonctionne uniquement comme carboxylase aboutissant à la synthèse de deux molécules de PGA (molécules en C3), à l’origine des sucres phosphorylés formés par le cycle de Benson-Bassham-Calvin.
RuBP (molécule en C5) + CO2 (molécule en C1) → 2 PGA (molécule en C3) (réaction de carboxylation)
En revanche, en présence d’une forte concentration en O2 et d’une faible concentration en CO2, la RubisCO donne naissance à une molécule de PGA (molécule en C3) et à une molécule à deux atomes de carbone, le phosphoglycolate (ou P-glycolate).
RuBP (molécule en C5) + O2 → PGA (molécule en C3) + P-glycolate (molécule en C2) (réaction d’oxygénation)
4.3. Le cycle de la photorespiration
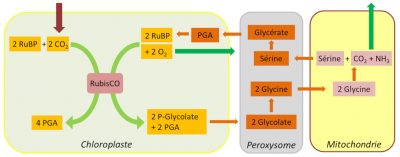
Outre ces pertes de carbone et d’azote, le recyclage du glycolate a également un coût énergétique non négligeable en NADPH et ATP. Toutefois, grâce au déroulement de la voie du glycolate, une grande partie du carbone issu de la photorespiration est finalement récupérée, limitant ainsi les pertes de carbone photosynthétique (Figure 7).
La photorespiration s’exprime surtout chez les plantes poussant dans les régions tempérées (blé, orge, tomate, laitue, pomme de terre, arbres), les plantes de photosynthèse de type C3. Il est estimé qu’à 25°C, dans les conditions d’environnement normales, c’est-à-dire 21% d’oxygène et 0,0408% de CO2, le rapport entre vitesse de carboxylation et d’oxygénation est voisin de 2,5, c’est-à-dire que l’émission de CO2 photorespiratoire correspond à peu près à une perte de 20% de l’assimilation photosynthétique de CO2. L’importance de la photorespiration est très liée aux conditions du milieu :
- Elle est d’autant plus importante que la température et l’éclairement sont élevés et que la teneur en CO2 de l’atmosphère est faible ;
- A l’inverse les tensions élevées en CO2 favorisent la carboxylation.
4.4. La photorespiration : un processus adaptatif majeur
Depuis plus de 3 milliards d’années, la photosynthèse, processus très robuste, a connu une très grande stabilité tout en s’adaptant aux changements environnementaux majeurs qu’a connus la Planète. L’évolution du métabolisme photosynthétique est associée aux transformations du milieu :
- Au fur et à mesure de l’augmentation de la teneur en oxygène dans l’atmosphère, le rapport CO2/O2 a diminué de manière spectaculaire et a provoqué une glaciation globale il y a environ 700 millions d’années.
- Ces conditions nouvelles ont induit une forte pression d’oxygène sur le fonctionnement de la RubisCO chez les microorganismes et les algues, antérieurement à la colonisation des continents. [11]
- S’adaptant à ces conditions nouvelles, la branche de la lignée verte (ancêtre des végétaux terrestres) a développé la voie photorespiratoire, qui à son tour a permis la colonisation ultérieure des continents, il y a environ 430 millions d’années.
- Une fois à l’air libre, les plantes ont dû faire face à cette nouvelle pression évolutive et ont cherché à réduire ou à contourner la photorespiration par différentes stratégies.
La photorespiration est donc un processus photosynthétique inévitable car il est lié aux propriétés intrinsèques de la RubisCO qui s’est formée lors de l’évolution à une époque où la teneur en oxygène du milieu était presque négligeable [12].
D’autres organismes photosynthétiques ont élaboré des stratégies plus originales que celle des plantes C3 pour réduire efficacement les effets néfastes de l’oxygène sur la RubisCO : concentrer le CO2 près de l’enzyme.
5. Concentrer le CO2 au voisinage de la RubisCO
5.1. Les bactéries photosynthétiques : créer un réservoir de CO2 près de la RubisCO
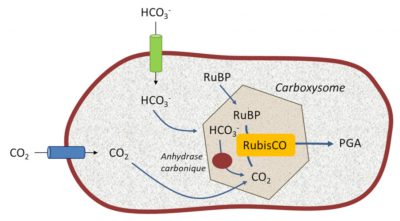
Ces structures permettent aux cyanobactéries de vivre dans des milieux aquatiques pauvres en CO2 dissous mais riches en ions bicarbonate HCO3–. Des transporteurs spécifiques et efficaces, situés sur leur membrane limitante, captent le bicarbonate HCO3– qu’elles transforment en CO2 grâce à des anhydrases carboniques*. Ce mécanisme permet de créer un réservoir interne de dioxyde de carbone concentré dans l’environnement proche de leur RubisCO, recréant ainsi l’atmosphère primitive des périodes géologiques anciennes. Cela favorise l’activité carboxylase de la RubisCO aux dépends de l’activité oxygénase. [13]
5.2. Les plantes C4 : séparer physiquement fixation du CO2 et RubisCO
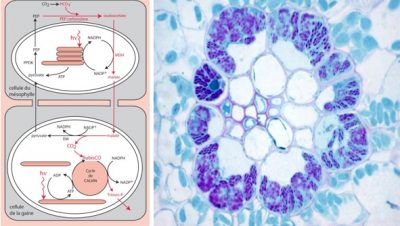
- l’un entourant les vaisseaux conducteurs, le tissu le plus externe, le mésophylle,
- l’autre entourant le tissu le plus interne, la gaine périvasculaire (emboitement de type de poupées russes, très étanche).
Les cellules du mésophylle, contiennent des carboxylases spécifiques, les phosphoénol-pyruvate-carboxylases ou PEP-carboxylases, qui catalysent la formation d’un composé à quatre carbones (d’où le nom de photosynthèse ou de plantes de type C4), l’oxalo-acétate [14] :
PEP (molécule en C3) + Bicarbonate (molécule en C1) → Oxalo-acétate (molécule en C4)
Dans le chloroplaste du mésophylle, l’oxalo-acétate est transformé en un autre composé en C4, le malate, et migre dans les cellules de la gaine. Là, après décarboxylation enzymatique de ce composé à quatre carbones, une quantité importante de CO2 s’accumule dans l’environnement proche de la RubisCO, favorisant son activité carboxylase. Le phosphoénol-pyruvate est alors régénéré pour assurer la pérennité du cycle.
Ce mécanisme -qui sépare physiquement la capture du dioxyde de carbone atmosphérique et son utilisation par la RubisCO– a toutefois un cout énergétique supplémentaire en ATP par rapport au mécanisme C3 de photosynthèse. [15]
5.3. Séparation temporelle chez les plantes grasses : métabolisme C4 la nuit et C3 le jour
Chez les plantes grasses (cactées, ananas, etc.) ou plus généralement les plantes à métabolisme crassulacéen, dénommées en anglais plantes CAM (pour Crassulacean acid metabolism), les fonctions de concentration en CO2 et de carboxylation de la RubisCO sont localisées dans un même tissu. Mais elles fonctionnent en métabolisme C4 de nuit, assurant la synthèse de malate, et en métabolisme C3 de jour après décarboxylation du malate en CO2. [16] (Lire Focus La joubarbe : exemple d’adaptation d’une plante aux contraintes environnementales).
6. La photosynthèse dans un environnement changeant
6.1. Les différents types de métabolismes permettent-il une adaptation aux changements de l’environnement ?

Sous fort éclairement et températures élevées, les plantes de photosynthèse C4 qui ne manifestent quasiment pas d’activité photorespiratoire sont plus efficaces pour assimiler le carbone du CO2 atmosphérique que les plantes C3, à condition que l’eau et les minéraux ne soient pas limitants. Ainsi, les 5 % d’espèces végétales C4 sur la planète fixent 30 % du CO2 mondial. De plus :
- pour une même production de biomasse, elles utilisent au moins un tiers de moins d’eau du fait de leur structure foliaire en manchon. Seulement 350 litres d’eau sont nécessaires pour produire 1 kg de farine de maïs (plante C4, Figure 10) contre 500 litres d’eau pour 1kg de farine de blé (plante C3, Figure 11) ;
- elles mobilisent moins d’azote que les plantes C3 car l’efficacité des PEP-carboxylases permet de réduire la quantité de RubisCO -enzyme très riche en azote-, dans les feuilles C4 pour atteindre la même activité photosynthétique que les plantes de type C3.

D’ailleurs, si la concentration en CO2 continue à s’élever dans l’atmosphère comme on le constate actuellement (Lire Un cycle du carbone perturbé par les activités humaines), les plantes de type C3 pourraient atteindre des activités photosynthétiques approchant celles des plantes de type C4 à la condition que les températures restent modérées.
6.2. Et dans le futur ?
Ces informations laissent à penser qu’au cours des décennies à venir les plantes vont acquérir des mécanismes adaptés à leur nouvel environnement.
Notre meilleure connaissance des différents mécanismes d’adaptation des plantes aux changements de l’environnement permet d’envisager de développer des plantes mieux adaptées aux changements rapides de la teneur en CO2, de l’élévation de la température, de la disponibilité en eau, etc. Parmi les nombreuses recherches en cours, on ignore aujourd’hui lesquelles d’entre elles se révèleront profitables et seront susceptibles d’une application agricole ou industrielle à grande échelle. Le focus Améliorer la photosynthèse ? présente quelques pistes possibles.
7. Messages à retenir
- Les plantes et certaines bactéries, par la photosynthèse, transforment une partie de la lumière solaire en énergie chimique stable et fixent simultanément le carbone du dioxyde de carbone CO2, de manière à élaborer toutes les molécules organiques nécessaires au développement de la vie.
- L’utilisation du 14C radioactif comme marqueur moléculaire et le développement des techniques analytiques ont permis de suivre le cheminement métabolique du carbone et de mettre en évidence le cycle de Benson-Bassham-Calvin. Ce cycle assure la régénération de l’accepteur du carbone du CO2 et la synthèse des molécules élémentaires à l’origine des glucides, lipides nécessaires à l’élaboration et au fonctionnement des cellules photosynthétiques.
- La fixation du carbone du CO2 qui intègre le cycle de Benson-Bassham-Calvin est catalysée depuis plusieurs milliards d’années par une enzyme spécifique de la photosynthèse, la ribulose bisphosphate carboxylase (RuBP carboxylase).
- Suite à l’augmentation de la teneur en oxygène de la planète (dans l’atmosphère et les océans), la RuBP carboxylase a fixé également l’oxygène, manifestant ainsi non seulement une fonction carboxylase mais également oxygénase d’où son nom RubisCO.
- La fonction oxygénase est à l’origine de la synthèse d’une molécule de phospho-glycolate, un puissant inhibiteur du cycle de Benson-Bassham-Calvin. Les plantes au cours de l’évolution ont retenu une voie métabolique qui a permis d’éliminer le P-glycolate avec émission de CO2, d’où le nom de cycle photorespiratoire.
- D’autres organismes photosynthétiques ont développé une stratégie, plus originale et plus efficace, en créant un mécanisme supplémentaire, le cycle C4, assurant autour de la RubisCO un environnement riche en CO2, plus favorable à la carboxylation et minimisant ainsi au mieux l’activité oxygénase inhibitrice de la photosynthèse.
Notes et références
Nous remercions les Editions Dunod et QUAE pour nous avoir autorisés à reproduire des figures pour cet article.
Image de couverture. [Source : Photo © Jean-François Morot-Gaudry]
[1] Le carbone 11 (11C) est un isotope du carbone dont la demi-vie est de 20,38 minutes. Les expériences utilisant cet isotope radioactif doivent donc être très courtes car il ne peut plus être détecté après quelques heures. Il est couramment utilisé pour marquer des molécules en « tomographie par émission de positons ».
[2] Benson, A.A. (1951) Identification of ribulose in 14CO2 photosynthesis products. J. Am. Chem. Soc. 73:2971-2972.
[3] Bassham, J. A., Benson, A. A., Kay, L. D., Harris, A. Z., Wilson, A. T. & Calvin, M. (1954) The path of carbon in photosynthesis. XXI. The cyclic regeneration of carbon dioxide acceptor. J. Am. Chem. Soc. 76:1760–1770.
[4] La biologie est fondée sur la chimie du carbone, en raison de son potentiel électrochimique, c’est-à-dire la partie de la chimie qui étudie les transformations réciproques de l’énergie chimique et de l’énergie électrique. Ce potentiel très élevé se montre capable d’entretenir quatre liaisons chimiques différentes à la fois, ce qui permet de multiplier les différentes possibilités de combinaisons atomiques et moléculaires, sources de la diversification des molécules organiques indispensables aux différents processus d’évolution et de développement de la vie.
[5] Le Dalton est une unité de mesure standard, utilisée pour exprimer la masse des atomes et des molécules. Défini initialement comme égal à 1/12 de la masse d’un atome de carbone 12. Le kilodalton (kDa) est beaucoup plus utilisé en biologie et biochimie, du fait de la taille des molécules. La plupart des molécules cellulaires ont typiquement une masse comprise entre 20 et 100 kDa.
[6] L’azote est un constituant majeur des acides aminés et des protéines (environ 6% de la masse d’une protéine).
[7] Otto Heinrich Warburg (1883-1970), médecin, physiologiste et biochimiste allemand. Lauréat du prix Nobel de physiologie ou médecine de 1931 « pour sa découverte de la nature et du mode d’action de l’enzyme respiratoire. »
[8] Actuellement, le taux de CO2 dans l’atmosphère a dépassé les 400 ppm (0,04%). Des valeurs supérieures à 415 ppm ont été enregistrées tout au long de l’année 2019 à l’observatoire du Mauna Loa à Hawaii.
[9] Lorimer G.H. (1981). The carboxylation and oxygenation of ribulose 1,5-bisphosphate: The primary events in photosynthesis and photorespiration. Annu. Rev. Plant Physiol. 32: 349-383.
[10] Tolbert N.E. (1997). The C2 oxydative photosynthetic carbon cycle. Annu. Rev. Plant Physiol. Plant Mol. Biol. 48: 1-25.
[11] Hagemann M., Kern R., Maurino V.G., Hanson D.T., Weber A.P.M., Sage R.F. & Bauwe H. (2016) Evolution of photorespiration from cyanobacteria to land plants, considering protein phylogenies and acquisition of carbon concentrating mechanisms. J. Exp. Bot., 67:2963–2976.
[12] Erb T.J. & Zarzycki J. (2018) A short history of RubisCO: the rise and fall (?) of Nature’s predominant CO2 fixing enzyme. Curr. Opin. Biotechnol., 49:100-107
[13] Badger M.R., Price, G.D., Long B.M. & Woodger F.J. (2006). The environmental plasticity and ecological genomics of the cyanobacterial CO2 concentrating mechanism. J. Exp. Bot. 57: 249-265.
[14] L’oxaloacétate est rapidement réduit en malate qui migre dans les chloroplastes de la gaine périvasculaire.
[15] Christin P.A. & Osborne C.P. (2014) The evolutionary ecology of C4 plants. New Phytol. 204(4):765-781; Hatch M.D. & Slack C.R. (1970). Photosynthetic CO2-fixation pathways. Ann. Rev. Plant Physiol. 21: 141-162 ; https://inee.cnrs.fr/fr/cnrsinfo/des-echantillons-dherbiers-revelent-les-origines-de-la-photosynthese-du-mais.
[16] Koteyeva N.K., Voznesenskaya E.V., BerryJ.O., Asaph B., Cousins A.B. & Edwards G.E. (2016)synthesis along longitudinal leaf gradients in Bienertia sinuspersici and Suaeda aralocaspica (Chenopodiaceae). J. Exp. Bot. 67 (9) : 2587-2601.
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : MOROT-GAUDRY Jean-François, JOYARD Jacques (1 octobre 2020), Le chemin du carbone dans la photosynthèse, Encyclopédie de l’Environnement. Consulté le 27 juillet 2024 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/vivant/chemin-carbone-photosynthese/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.







