La RubisCO
PDF1. De la « Fraction 1 Protein » à la RubisCO
C’est Sam Wildman [1] qui le premier a caractérisé cette protéine autour des années 1950. [2] L’abondance de la RubisCO dans les chloroplastes de feuilles de plantes de type C3 (30 à 50% des protéines), et son poids moléculaire élevé (550 kDa) expliquent pourquoi le fractionnement d’extraits foliaires à l’aide de sulfate d’ammonium a conduit à la préparation d’une fraction protéique homogène appelée « Fraction 1 » représentant une fraction importante des protéines foliaires. Dénommé « Fraction 1 protein » par commodité, le contenu de cette fraction a été très largement caractérisé par électrophorèse, centrifugation analytique, cristallisation, etc.
Mais sa fonction enzymatique restait un mystère. Elle fut découverte par une autre voie. Après le décryptage du Cycle de Benson-Bassham-Calvin, les chercheurs se sont lancés à la recherche de l’enzyme catalysant la fixation du CO2 sur le Ribulose 1,5-diphosphate suivi par la dismutation en deux molécules de 3-PGA (Lire Focus Décryptage du cycle de Benson-Bassham-Calvin). Découverte en 1956 [3], cette enzyme fut appelée carboxydismutase. Il n’a alors fallu que très peu de temps pour démontrer que l’enzyme ainsi identifiée et la « Fraction 1 protein » n’étaient qu’une seule et même protéine : la Ribulose bisphosphate (ou RuBP) Carboxylase.
Puis, dans les années 1970, la capacité de la ribulose biphosphate carboxylase à fixer aussi le dioxygène a été démontrée. [4] Cette enzyme est donc bifonctionnelle et exerce en plus de son activité carboxylase une seconde activité appelée oxygénase, d’où le nom de RubisCO (Ribulose biphosphate Carboxylase Oxygénase).
La RubisCO, enzyme spécifique de la photosynthèse, est la porte d’entrée du carbone dans la majorité des molécules organiques de la Planète et ce depuis plus de trois milliards d’années. Elle est aussi à l’origine de la photorespiration, voie métabolique apparue beaucoup plus tardivement, avec l’augmentation de la teneur en oxygène de l’atmosphère. C’est l’enzyme la plus importante quantitativement de la biosphère. De plus elle constitue la principale réserve d’azote organique des feuilles.
2. Structure de la RubisCO
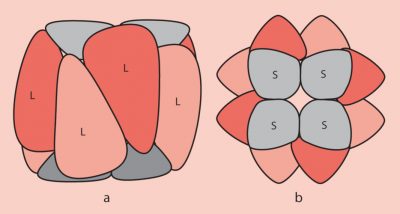
- Les grandes sous-unités sont codées dans le stroma du chloroplaste par le génome chloroplastique ;
- Les petites sous-unités sont codées par le génome nucléaire des cellules photosynthétiques et sont importées ensuite dans le stroma du chloroplaste à travers les membranes externe et interne de cet organite ;
- Le repliement des polypeptides correspondant aux sous-unités et leur assemblage pour former la RubisCO fonctionnelle implique des protéines chaperons ;
- Au niveau fonctionnel, les grandes sous-unités portent les sites catalytiques. Les petites sous-unités, nécessaires à son fonctionnement, ont un rôle de régulation.
3. Activité de la RubisCO
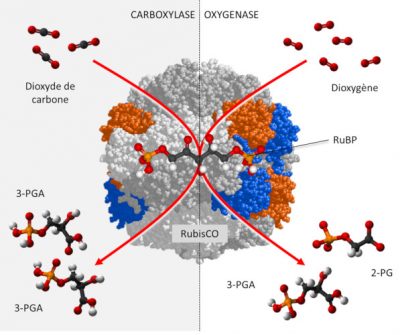
La RubisCO est une carboxylase [6], qui assure -au sein du stroma du chloroplaste- la fixation du carbone du CO2 sur un sucre phosphorylé à 5 atomes de carbone, le RuBP ou Ribulose 1,5-bisphosphate (Lire Focus Décryptage du cycle de Benson-Bassham-Calvin), pour former une molécule instable à 6 atomes de carbone qui donnera rapidement deux molécules d’acide 3-phosphoglycérique (3-PGA) à 3 atomes de carbone selon la réaction :
RuBP + CO2 → 2 3-PGA (réaction de carboxylation)
Par ailleurs, dioxyde de carbone et dioxygène sont en compétition au niveau des sites catalytiques de la RubisCO :
- En présence d’une concentration élevée de CO2, la RubisCO fonctionne uniquement comme carboxylase aboutissant à la synthèse de molécules de PGA réduites en trioses phosphate, à l’origine des sucres phosphorylés formés par le cycle de Benson-Bassham-Calvin.
- En revanche, en présence d’une forte concentration en O2 et d’une faible concentration en CO2, la RubisCO donne naissance à une molécule de PGA et à une molécule à deux carbones, le phosphoglycolate (P-glycolate), rapidement déphosphorylé en glycolate.
RuBP + O2 → PGA + P-glycolate (réaction d’oxygénation)
De fait, le CO2 et l’O2 sont impliqués dans deux activités antagonistes (Lire Le chemin du carbone dans la photosynthèse). (Figure 2) :
- le dioxyde de carbone favorisant la fonction carboxylase de la RubisCO ;
- le dioxygène favorisant la fonction oxygénase manifestée par la photorespiration.
Préalablement à ces réactions, la RubisCO doit être modifiée dans sa conformation par une RubisCO activase en présence d’ATP, et activée par le CO2 en présence de magnésium.
La RubisCO n’est pas une enzyme très active : la valeur de son turnover moyen (ou constante catalytique) est située entre 1 à 10 s-1. Ce qui signifie que chaque molécule de RubisCO peut, selon les conditions, produire entre une et 10 molécules de G3P par seconde, ce qui est faible.[7] C’est l’étape limitante du Cycle de Benson-Bassham-Calvin. Elle peut donc devenir un facteur limitant de la photosynthèse, même dans des conditions favorables.
La faible activité de la RubisCO a des raisons mécaniques et évolutives. La RubisCO a évolué avant le premier grand événement d’oxygénation dans une atmosphère dépourvue d’oxygène, de sorte que son mécanisme fonctionnel n’était pas contraint par la présence de ce gaz. Lorsque la teneur en oxygène de l’atmosphère a augmenté, la RubisCO a dû faire la distinction entre dioxyde de carbone et dioxygène. Or plus une enzyme est spécifique plus sa fonction catalytique est lente. Pour mieux discriminer entre dioxygène et dioxyde de carbone, la RubisCO a donc réduit sa vitesse de réaction. [8]
4. Origine de la RubisCO
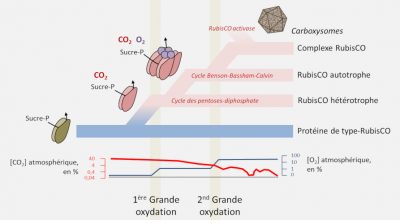
- Les protéines de la superfamille RPL/RubisCO ont probablement pour origine une enzyme non fixatrice de CO2 de type énolase.[9] C’est au sein de cette famille que serait apparue une véritable carboxylase ;
- La RubisCO serait apparue chez des archées dans un contexte non autotrophe à partir du métabolisme des nucléotides avant qu’une autotrophie dépendant de la RubisCO n’apparaisse chez des bactéries avec le cycle de Benson-Bassham-Calvin ;
- Afin d’optimiser le flux de carbone la RubisCO serait ensuite passée d’une enzyme autonome à un complexe enzymatique, l’évolution ultime se retrouvant dans les cyanobactéries avec les carboxysomes ou les pyrénoïdes des algues.
Notes et références
Image de couverture.
[1] Samuel Goodnow Wildman (1912-2004), biologiste américain.
[2] Wildman S.G. & Bonner J. (1947) The proteins of green leaves. I. Isolation, enzymatic properties and auxin content of spinach cytoplasmic proteins. Arch. Biochem. 14:381–413; Singer S.J., Eggman L., Campbell J. & Wildman S.G. (1952) The proteins of green leaves. IV. High molecular weight protein comprising a large part of the cytoplasmic proteins. J. Biol. Chem. 197:233–239; Wildman S.G. (2002) Along the trail from Fraction I protein to Rubisco (ribulose bisphosphate carboxylase-oxygenase). Photosynth. Res. 73:243-250.
[3] Weissbach A., Horecker B.L. & Hurwitz J. (1956) The enzymatic formation of phosphoglyceric acid from ribulose diphosphate and carbon dioxide. J. Biol. Chem. 218: 795–810.
[4] Lorimer G.H. (1981). The carboxylation and oxygenation of ribulose 1,5-bisphosphate: The primary events in photosynthesis and photorespiration. Annu. Rev. Plant Physiol. 32: 349-383.
[5] Anderson I. & Backlund A. (2008) Structure and function of RubisCO. Plant Physiol Biochem. 46(3):275-91
[6] Une carboxylase est une enzyme qui fixe le carbone minéral (qui est oxydé) en carbone organique (qui est réduit) et assure ainsi l’incorporation du CO2 dans les molécules lors de la synthèse de glucides. Les réactions de carboxylations sont endergoniques, c’est-à-dire qu’elles ne peuvent se réaliser que grâce à une dépense d’énergie (en général fournie par la déphosphorylation d’une molécule d’adénosine triphosphate)
[7] A titre de comparaison, une des enzymes les plus rapides -l’anhydrase carbonique- a une constante catalytique pouvant atteindre 106 s−1, ce qui signifie que chaque molécule d’anhydrase carbonique peut produire jusqu’à un million d’ions bicarbonate par seconde.
[8] Erb T.J. & Zarzycki J. 2018, A short history of RubisCO: the rise and fall (?) of Nature’s predominant CO2 fixing enzyme. Cur. Op. Biotech. 49, 100-107 – https://doi.org/10.1016/j.copbio.2017.07.017
[9] L’énolase catalyse la conversion du 2-phosphoglycérate (2-PG) en phosphoénolpyruvate (PEP),




