Dialogues et coopération chez les bactéries
PDF
La communication et la coopération sociales sont-elles l’apanage des animaux ? Pas du tout : elles existent aussi chez de nombreux végétaux et organismes unicellulaires, tels que les bactéries. Chez ces dernières, le comportement social dépend notamment de la densité locale des individus. Ainsi les bactéries Vibrio fischeri, entre autres espèces, disposent d’un système de communication dépendant de la densité, dit ‘quorum sensing’, qui leur permet de coordonner leurs activités et de coopérer à haute densité cellulaire. Comment ce système fonctionne-t-il ? Pourquoi et comment a-t-il pu évoluer? Est-il répandu chez les bactéries, et existe-t-il chez d’autres microorganismes ? Quelles sont les réponses des espèces ‘hôtes’ au quorum sensing de bactéries pathogènes? Comprendre les mécanismes du quorum sensing peut-il aider les microbiologistes à contrôler les attaques microbiennes, telles que la formation de biofilms par des bactéries pathogènes? Telles sont quelques-unes des questions explorées par les chercheurs en biologie évolutive et en microbiologie depuis le tournant du siècle.
- 1. Associations hôtes – microbiotes : un écosystème complexe
- 2. Un modèle historique : les bactéries bioluminescentes de la seiche Euprymna scolopes
- 3. Les multiples usages du quorum sensing
- 4. Évolution et adaptation du quorum sensing
- 5. Détournements et exploitation du signal
- 6. Manipuler les dialogues moléculaires
- 7. Collaborer, ou pas ? Telle est la question…
- 8. Un système à explorer, dans de multiples domaines !
- 9. Messages à retenir
1. Associations hôtes – microbiotes : un écosystème complexe
Qu’ils soient plantes, animaux, algues ou champignons, tous les organismes multicellulaires (ou : macroscopiques que nous distinguons à l’œil nu) hébergent à leur surface et dans certains organes des communautés microbiennes abondantes dites ‘microbiotes’, comportant bactéries, protistes* (tels qu’amibes et champignons unicellulaires), éventuellement archées*. De telles associations entre macro- et micro-organismes ne sont bien sûr pas neutres pour les participants, en termes de survie et de reproduction. Coévoluant entre elles et avec l’espèce hôte depuis maintes générations, tout ou partie des espèces membres d’un microbiote peuvent notamment contribuer de manière importante au fonctionnement physiologique de leur hôte (dit aussi ‘macrobionte’), nouant ainsi une relation de dépendance réciproque ou symbiose* avec celui-ci (Lire Symbiose et parasitisme). C’est le cas du microbiote du tube digestif des humains, récemment popularisé par le livre de Giulia Enders « Le charme discret de l’intestin » [1] et décrit dans un autre article de cette encyclopédie (Lire Les microbiotes humains : des alliés pour notre santé).
Hôte et microbiote sont ainsi alliés… jusqu’à un certain point ! Si la relation n’est pas toujours bénéfique aux deux parties, c’est notamment parce qu’à la différence du premier -issu de la division cellulaire d’une unique cellule-, le second n’est pas un organisme individuel, ni un ‘super organisme’ agissant à l’unisson. Appartenant à de nombreuses espèces différentes, les cellules d’un microbiote sont engagées dans de multiples relations écologiques et métaboliques, entre elles et avec leur hôte. Elles synthétisent ou dégradent et sécrètent dans le milieu extérieur de nombreux composés chimiques, qui ont des effets variés sur les autres cellules alentour, ainsi que sur leur hôte. Elles peuvent ainsi communiquer entre elles via des signaux chimiques (dits phéromones) et coopérer par la mise en commun d’outils moléculaires (tels que des enzymes ‘digestives’) ; mais aussi se combattre via l’émission de composés toxiques par exemple [2]. Toutes activités pouvant stabiliser la relation mutualiste* entre l’hôte et son microbiote, mais parfois aussi conduire à une attaque réglée de l’hôte par ce dernier !
Les ‘dialogues moléculaires’ entre cellules d’un microbiote sont complexes, comme le montrent les recherches des vingt dernières années dans le domaine. Parmi les signaux/messages chimiques émis par les bactéries, certains stimulent la coopération de bactéries réceptrices dans certaines conditions seulement, selon un mécanisme nommé ‘quorum sensing’ (ou ‘évaluation du quorum’). D’un point de vue microbiologique, appliqué à la médecine et à la santé publique, la compréhension des mécanismes en jeu dans cette coopération conditionnelle –qui se traduit souvent par un accroissement de la virulence et de la toxicité des populations bactériennes concernées, voir plus bas- ouvre de nombreuses perspectives. Plus largement, sur le plan théorique et évolutionniste, l’étude des mécanismes et enjeux du ‘quorum sensing’ bactérien permet d’explorer l’évolution de la coopération chez les bactéries [3].
2. Un modèle historique : les bactéries bioluminescentes de la seiche Euprymna scolopes

Lorsque celle-ci chasse au clair de lune, la bioluminescence des photophores réglée sur l’intensité de l’éclairage apical lui permet de compenser le déficit de lumière sur sa face ventrale et de masquer son ombre portée. C’est ainsi que, paradoxalement, émettre de la lumière permet à la sépiole de dissimuler sa présence aux yeux de ses ennemis, prédateurs et proies [4]. Un comportement très adaptatif ! Mais les cellules productrices de lumière, dans les photophores, n’appartiennent pas à la seiche : ce sont des bactéries symbiotiques de l’espèce Vibrio fischeri, capables de bioluminescence [5], qui coordonnent leur production de lumière sous contrôle du système neuroendocrinien de leur hôte… après avoir participé à son développement embryonnaire [4] ! Ce faisant, ces bactéries augmentent la probabilité de survie de leur hôte, son succès de reproduction, et en toute logique leur propre valeur sélective* !
Au début des années 1970, il a été montré que les bactéries Vibrio fischeri ne synthétisent l’enzyme luciférase nécessaire à la production de lumière que lorsque leur concentration atteint un seuil, ou quorum, que les bactéries sont capables de détecter7. Ce phénomène a été alors nommé quorum sensing. Il désigne un système de communication (chimique) entre cellules d’une population de bactéries, ou d’autres microorganismes, par lequel celles-ci s’informent mutuellement de leur densité locale, et qui permet le déclenchement et la coordination d’activités collectives à partir d’une certaine densité (Lire Focus Quorum sensing et messagers chimiques). Les bactéries présentent alors un comportement coopératif ou ‘social’, et sont capables de synchroniser l’expression de fonctions spécifiques à l’échelle d’une population de cellules microbiennes. Dans le cas des bactéries symbiotiques de la seiche, la fonction ainsi contrôlée est la production de lumière (bioluminescence).
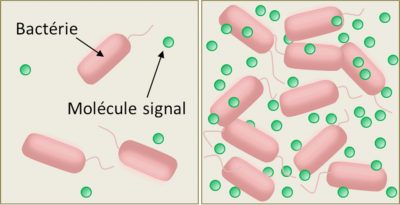
Le mécanisme est assez simple. Les bactéries capables de quorum sensing synthétisent et libèrent dans le milieu extérieur de petites molécules organiques jouant le rôle de signaux chimiques (phéromones), auxquelles elles sont elles-mêmes sensibles (Figure 2). La liaison du signal chimique avec un récepteur spécifique de la cellule (récepteur membranaire ou cytoplasmique, selon l’espèce) stimule la synthèse et la sécrétion de la phéromone -ce qui augmente la concentration locale de cette molécule-signal dans le milieu extra-cellulaire- selon un processus dit d’autoinduction ou d’autoentrainement. [C’est pourquoi les microbiologistes nomment ‘autoinducteurs’ les signaux chimiques du quorum sensing.] La concentration locale des signaux chimiques du quorum sensing varie donc avec la densité des bactéries (Figure 2).
A faible densité cellulaire, cette concentration est très faible, peu de molécules-signaux sont détectées avant d’être dégradées ou localement éliminées par diffusion ; le mode de fonctionnement (ou phénotype) des cellules reste donc stable, de type ‘individualiste’. Mais à partir d’un certain seuil de densité, du fait de la boucle d’autoinduction, la concentration locale de ces molécules fait basculer les cellules vers un autre mode de fonctionnement (ou phénotype), impliquant la synthèse de molécules utiles à l’ensemble du groupe et favorisant leur coordination : un phénotype dit ‘social’ ou ‘coopératif’.
3. Les multiples usages du quorum sensing
Depuis les années 1980, l’utilisation du quorum sensing pour la synchronisation et coordination d’activités collectives a été vérifiée chez de très nombreuses bactéries (voir par exemple [2],[3]). Elle a aussi été mise en évidence chez des archées et chez certains champignons saccharomycètes présentant deux modes de croissance alternatifs (de type mycelium ou bourgeonnant) [6],[7].
Le quorum sensing contrôle de nombreuses fonctions chez ces microorganismes, avec d’importantes conséquences pour le fonctionnement du microbiote et la physiologie de l’hôte [2],[6]. Par exemple, diverses équipes de recherche s’interrogent sur le rôle du quorum sensing chez certaines souches de Vibrio appartenant au microbiote des huîtres et pouvant devenir pathogènes dans certaines conditions.
3.1. Virulence
De nombreux microorganismes contrôlent leur pathogénicité par quorum sensing : c’est le cas de bactéries pathogènes de plantes (Erwinia sp.), de la peau (par exemple le Staphylocoque doré, Staphylococcus aureus), de l’agent du choléra (Vibrio cholerae), ainsi vraisemblablement que du champignon Candida albicans. Chez d’autres bactéries, telles Escherichia coli et Klensiella sp., le quorum sensing contrôle la résistance collective aux antibiotiques assurée par la production et sécrétion d’enzymes (lactonase, notamment) capables de briser les molécules antimicrobiennes.
3.2. Formation de biofilms
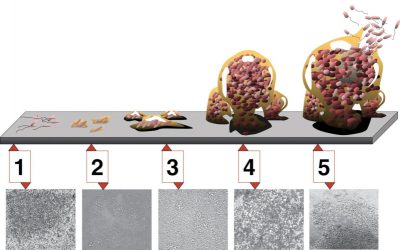
4. Évolution et adaptation du quorum sensing
Comment expliquer l’existence et l’évolution d’un tel système de communication sociale chez de nombreuses bactéries, archées et autres microorganismes peuplant des habitats isolés tels que les microbiomes ? Dans une approche tout à la fois écologique, génétique et évolutive, on peut souligner que la formation de communautés microbiennes denses dans des habitats locaux riches en nutriments, jointe au mode de fonctionnement habituel des microorganismes (modes d’alimentation, de reproduction, de défense, de communication..) favorisent l’évolution de tels systèmes.
La densité. De manière générale, la densité des cellules dans les microbiotes augmente la fréquence et la diversité des interactions chimiques et biophysiques entre espèces et à l’intérieur des populations de même espèce, interactions potentiellement avantageuses ou au contraire délétères pour les individus (en termes de valeur sélective*). Elle favorise donc l’évolution de multiples systèmes de communication s’appuyant sur ces interactions, systèmes dédiés à la coopération ou au contraire à l’évitement des partenaires écologiques [8],[9].
L’isolement. Par ailleurs, qu’elles soient confinées dans un organe de leur hôte ou concentrées autour d’une source de nutriments, l’isolement (même relatif) des communautés microbiennes augmente la consanguinité des populations locales de même ‘espèce’ – c’est à dire dans le cas des bactéries, de populations issues du clonage d’individus. Il favorise donc l’évolution de comportements sociaux au sein de ces populations locales [10],[11].
Au niveau d’intégration supérieur, les cellules d’un microbiote sont des ingénieurs de leur écosystème :
- leur densité locale est telle que, par leurs multiples activités métaboliques, elles modifient considérablement leur environnement biophysicochimique (à l’échelle de leur hôte).
- en retour, les modifications du milieu causées par l’activité collective de très nombreuses cellules favorisent l’émergence, l’évolution et le contrôle de comportements sociaux adaptatifs pour les individus en condition de forte densité [2],[3].
A l’instar de tous les comportements caractéristiques des espèces, ou de certaines catégories d’individus au sein des espèces – les juvéniles par exemple, ou les adultes reproducteurs, chez les animaux-, les signaux de communication et les comportements sociaux n’évoluent que s’ils augmentent la valeur sélective inclusive* des individus qui les performent. C’est le cas de la chasse collective des loups ou de la défense collective des suricates par exemple, qui n’impliquent dans les deux cas que des adultes et subadultes (pour la plupart apparentés aux juvéniles du groupe). Il en va de même pour les activités bactériennes contrôlées par quorum sensing… à une autre échelle numérique !
Pour être efficace à l’échelle de leur hôte sépiole (ou à celle de l’holobionte sépiole-bactéries), l’émission de lumière par des bactéries V. fischeri doit être massive et synchronisée. La synthèse de luciférase et les chaînes de réactions impliquées dans l’émission de lumière, cependant, sont des activités physiologiques très coûteuses en énergie, pénalisantes (au plan adaptatif) lorsqu’elles sont sans effet, comme dans le cas de bactéries peu nombreuses ou/et mal coordonnées. En bref, ces activités ne sont adaptatives pour les bactéries que dans certaines conditions de densité.
De la même manière, la synthèse et la sécrétion dans le milieu extérieur, par des bactéries en mode « social », de grosses molécules coûteuses en énergie telles qu’enzymes, polysaccharides, sidérophores et autres « outils moléculaires », utiles à la collectivité, ne bénéficient aux bactéries sécrétrices (en termes de valeur sélective inclusive*) que si celles-ci sont entourées de nombreuses cellules agissant de même, souvent issues du même clone. Il s’agit en d’autres termes de production et mise à disposition d’autres cellules de « biens publics » coûteux à produire (cf. réf. [2]), activités qui ne peuvent qu’être contre-sélectionnées en l’absence de réciprocité.
Dans ces conditions, l’évolution d’un système de communication et stimulation réciproque permettant aux collaborateurs potentiels de s’informer sur leur densité locale -via l’émission et la détection de petites molécules-signaux- et de coopérer à forte densité, ne peut qu’être favorisée par la sélection naturelle. En somme, le quorum sensing permet aux bactéries de coopérer si et seulement si les conditions biologiques (écologiques, génétiques) sont favorables aux participants… sauf détournement du système !
5. Détournements et exploitation du signal
Chez les microorganismes, comme chez les animaux ou les végétaux, tout système de communication ne peut évoluer -et éventuellement se stabiliser- que s’il favorise une interaction fonctionnelle entre deux ou plusieurs parties (partenaires de reproduction, congénères sociaux, partenaires écologiques, compétiteurs alimentaires ou sexuels…), au bénéfice de chacune d’elles (voir par exemple [8],[9]. Les partenaires de communication peuvent alors être désignés comme l’émetteur et le ou les ‘destinataires biologiques’ des signaux.
Émetteurs et ‘destinataires biologiques’, cependant, n’occupent pas seuls leur habitat : ils côtoient de nombreux autres organismes, potentiels détecteurs et utilisateurs de toute information (et de toute ressource matérielle potentielle) véhiculée par les manifestations chimiques, visuelles, sonores, etc., des espèces présentes. Le chant d’un rossignol mâle sur une branche, par exemple, est entendu tout autant par la martre chasseuse et par les promeneurs humains que par les membres de son espèce auxquels il s’adresse (partenaire sexuelle actuelle ou potentielle, rivaux sexuels, ..).
L’émission d’un signal n’évolue que si son effet chez l’ensemble des organismes qui le perçoivent et y réagissent –qu’ils soient partenaires fonctionnels ou non- est globalement bénéfique aux émetteurs (en termes de valeur sélective inclusive)… dans les conditions de vie habituelles des espèces. Cela n’interdit pas pour autant la détection, l’exploitation ou/et l’éventuel détournement de signaux par d’autres organismes, partageant le même habitat, auxquels ils ne sont pas destinés. Et c’est bien sûr le cas pour le quorum sensing bactérien.
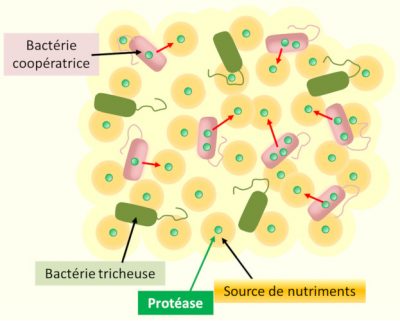
L’existence de souches bactériennes mutantes, insensibles aux signaux de quorum sensing de leurs congénères, a été mise en évidence chez plusieurs espèces. Dispensés des synthèses coûteuses en énergie de leur congénères ‘sociaux’, mais bénéficiant des activités enzymatiques et des outils moléculaires (dits ‘biens publics’) libérés dans le milieu extérieur par ces derniers, ces mutants inconditionnellement individualistes sont à court terme plus compétitifs que leurs congénères sociaux, et se répandent initialement dans les populations. Ce sont en d’autres termes des ‘tricheurs’, qui parasitent un système de communication et coopération auxquels ils ne contribuent pas (Figure 4). [12]
La fraction croissante de ces ‘tricheurs’, cependant, réduit progressivement la densité locale des cellules en mode social. Elle réduit donc tout à la fois la productivité du groupe (entravant le fonctionnement collectif de la population locale) et la densité des signaux de quorum sensing, ce qui à terme met fin à la coopération locale [13].
L’exploitation des signaux de quorum sensing émis par les bactéries n’est bien sûr pas l’exclusivité de mutants ‘tricheurs’ insensibles à ces signaux, apparaissant de temps à autre dans les lignées bactériennes. En théorie, la sélection naturelle doit favoriser l’utilisation ou le détournement d’un signal chez toute espèce fréquentant le même habitat susceptible de percevoir ce signal, et chez l’espèce-hôte elle-même, dès lors que cette utilisation augmente le succès de reproduction moyen des individus. Il s’agit là d’exploitation d’un système de communication préexistant, dont l’évolution exercera en retour une pression de sélection sur les émetteurs ou/et destinataires biologiques du signal (cf. par ex. [8] et voir plus bas).
6. Manipuler les dialogues moléculaires
Les composés impliqués dans le quorum sensing contrôlent des fonctions importantes chez les microorganismes qui sont souvent nuisibles pour l’homme, comme la pathogénicité ou la capacité à former des biofilms. De nombreuses équipes de recherche ont pour ambition de manipuler ces dialogues moléculaires pour contrôler, limiter ou stopper ces activités microbiennes. L’enjeu est d’autant plus important que la résistance des microorganismes aux antibiotiques connus est croissante. La recherche de stratégies alternatives de lutte est donc essentielle.
Pour atteindre cet objectif, les chercheurs s’inspirent (dans une démarche biomimétique ou/et évolutionniste) des stratégies d’exploitation de signaux observées dans la nature. On sait aujourd’hui que de nombreuses espèces notamment hôtes sont capables d’inhiber les dialogues moléculaires de quorum sensing entre cellules microbiennes: ce phénomène est appelé quorum quenching, ou étouffement du quorum.

Les applications du quorum quenching sont donc multiples, et beaucoup ne sont encore qu’au stade expérimental. Certaines équipes ont utilisé des bactéries du genre Bacillus pour lutter contre des pathogènes de poisson en aquaculture [15]. Ces bactéries sécrètent des enzymes dégradant les messagers de quorum sensing. Ajoutées à l’aide de petites billes dans la nourriture des poissons, elles permettent de lutter en bassin d’aquaculture ou en aquarium contre les pathogènes, par la dégradation des messagers chimiques contrôlant leur coordination. D’autres tentent des stratégies proches pour lutter contre les biofilms qui se développent sur les membranes de filtration dans l’industrie [16].
Certaines perspectives semblent particulièrement prometteuses en médecine. Il est connu que les antibiotiques modifient de façon importante notre flore intestinale. Les déséquilibres induits peuvent favoriser l’apparition de certains pathogènes et maladies. Mais une étude récente [17] a montré que l’injection d’une bactérie surproductrice d’une molécule de quorum sensing (l’AI-2) dans l’intestin d’une souris permet de contrôler les populations microbiennes qui s’y développent. Ainsi, après un traitement antibiotique néfaste pour la microflore, l’injection de cette souche permet de retrouver un microbiote plus diversifié, en particulier enrichi en Firmicutes.
7. Collaborer, ou pas ? Telle est la question…
L’union fait la force, dit-on. Cette maxime semble une évidence, presque une lapalissade, à nos yeux humains : les comportements sociaux, la coopération, l’organisation entre congénères ou alliés permettent de réaliser à plusieurs des actions bénéfiques à l’ensemble des participants, mais hors de portée d’individus indépendants, agissant chacun pour soi.
Cependant, même dans le règne animal qui se distingue en ce domaine, coopérer n’est pas une règle d’or. A l’inverse des cygnes et de la plupart des oiseaux, les canes Colvert élèvent seules leurs petits. Proches cousins des lions, les tigres chassent en solo. Si l’Abeille domestique est très sociale (eusociale), de nombreuses espèces d’abeilles sont solitaires… Force est de reconnaître et de questionner les multiples rôles de l’environnement physique, biologique et social dans l’évolution des comportements ‘altruistes’ et de la communication [18]. Il en va de même pour les microorganismes.
De manière générale, coopérer comporte des coûts et des risques. Ne serait-ce que ceux associés à l’émission des signaux de communication et à la détection de ces signaux par des organismes non destinataires, peu enclins à collaborer : compétiteurs, prédateurs, parasites (e.g. [8],[9]). C’est pourquoi le comportement social et la coopération ne peuvent évoluer que si les bénéfices – en termes de valeur sélective, c’est-à-dire de transmission de gènes aux générations suivantes – excèdent ces coûts. D’où l’évolution du quorum sensing chez nombre de bactéries, qui peuvent ainsi passer d’inoffensives à pathogènes pour leur hôte selon l’efficacité de ses défenses ou/et du contexte microbiotique par exemple ; d’où l’expansion épisodique mais à court terme de ‘tricheurs’ insensibles aux signaux sociaux, dans les populations bactériennes contrôlant leur coopération par quorum sensing ; et d’où l’évolution du ‘quorum quenching’ chez les espèces hôtes ou compétitrices de ces bactéries.
8. Un système à explorer, dans de multiples domaines !
L’étude des interactions microbiennes est un sujet de recherche en pleine évolution. La caractérisation des messagers chimiques impliqués, l’identification des fonctions microbiennes qu’ils gouvernent restent des enjeux de la recherche actuelle. Au-delà de la recherche médicale, les recherches en biologie évolutive et en écologie sur le quorum sensing suggèrent que ce système de coopération conditionnelle joue un rôle important dans l’évolution des symbioses et autres interactions entre ‘microbiontes’ et ‘et leurs hôtes, ainsi que dans l’adaptation des communautés microbiennes aux changements environnementaux actuels. Son étude a ainsi toute sa place en sciences de l’environnement, au service de la transition écologique.
9. Messages à retenir
- Mécanisme clef du comportement social des bactéries, le quorum sensing repose sur l’émission et la détection par les cellules de petites molécules-signaux, ou « molécules-clés », dont la concentration dans le milieu extérieur augmente avec celle des bactéries.
- Au-delà d’un certain seuil de concentration dans le milieu extérieur, ces molécules-clés provoquent le basculement des cellules vers un autre mode de fonctionnement, de type coopératif.
- Caractéristiques de chaque « espèce » ou souche bactérienne, les signaux moléculaires du quorum sensing sont très diversifiés.
- Ce mécanisme n’est pas spécifiquement bactérien : il a récemment été mis en évidence chez d’autres microorganismes, protistes et archées.
- Au plan théorique et évolutionniste, l’étude du quorum sensing permet d’explorer l’évolution du comportement social chez les bactéries et autres microorganismes, ainsi que l’évolution des interactions –symbioses notamment- entre ceux-ci et leurs hôtes.
- Le quorum sensing a été très étudié chez des souches d’intérêt médical, où il commence à être manipulé pour limiter les activités bactériennes néfastes pour l’homme.
Notes et références
Image de couverture. La petite seiche Euprymna scolopes [Source : Chris Frazee and Margaret McFall-Ngai [CC BY 4.0]
[1] Enders, G (2015). Le Charme discret de l’intestin: tout sur un organe mal aimé. Éditions Actes Sud.
[2] West S.A., S.P. Diggle et al., 2007. The social live of microbes. Annu. Rev. Ecol. Evol. Syst. 38:53–77.
[3] Diggle S.B. et al., 2007a. Evolutionary theory of bacterial quorum sensing – When is a signal not a signal ? Phil. Trans. R. Soc. B 362:1241-1249.
[4] McFall-Ngai M, 2014. Dividing the essence of Symbiosis: Insights from the squid-Vibrio Model. PLOS Biology 12(2): e1001783, doi:10.1371/journal.pbio.1001783.
[5] Nealson K, Platt T & Hastings JW (1970). The cellular control of the synthesis and activity of the bacterial luminescent system. Journal of Bacteriology 104 (1):313–22.
[6] Albuquerque P. & Casadevall A., 2012. Quorum sensing in fungi – a review. Medical Mycology 50:337–345.
[7] Zhang F., 2012. Acyl homoserine lactone-based quorum sensing in a methanogenic archaeon. ISME Journal 6:1336–1344.
[8] Teyssèdre A., 1993. La Communication animale, sur la scène de l’évolution. Paris, Nathan ; Teyssèdre A., 2006. Les clefs de la communication animale. Paris, Delachaux et Niestlé.
[9] Maynard Smith J. & D. Harper, 2003. Animal signals. New York, Oxford University Press.
[10] Hamilton, W. D. 1964. Genetical evolution of social behaviour I. J. Theor. Biol. 7:1–16.
[11] Maynard Smith J., 1989. Evolutionary Genetics. New York, Oxford University Press.
[12] Diggle S.P., Griffin A.S. et al., 2007. Cooperation and conflict in quorum sensing bacterial populations. Nature 450:411-414.
[13] Popat R., Crusz S.A. et al., 2012. Quorum-sensing and cheating in bacterial biofilms. Proc. R. Soc. B 279:4765–4771.
[14] Rasmussen TB, Manefield M, Andersen JB, Eberl L, Anthoni U, Christophersen C et al. (2000). How Delisea pulchra furanones affect quorum sensing and swarming motility in Serratia liquefaciens MG1. Microbiology 146(12):3237-3244
[15] Defoirdt T, Sorgeloos P & Bossier P (2011). Alternatives to antibiotics for the control of bacterial disease in aquaculture. Current opinion in microbiology 14(3): 251-258.
[16] Oh HS, Yeon KM, Yang CS, Kim SR, Lee CH, Park SY et al. (2012). Control of membrane biofouling in MBR for wastewater treatment by quorum quenching bacteria encapsulated in microporous membrane. Environmental Science & Technology 46(9): 4877-4884.
[17] Thompson JA, Oliveira RA, Djukovic A, Ubeda C & Xavier KB (2015). Manipulation of the quorum sensing signal AI-2 affects the antibiotic-treated gut microbiota. Cell reports 10(11):1861-1871.
[18] Krebbs J.R. & N.N. Davies (Eds), 1991, 1997. Behavioural Ecology. Oxford, Black Well Scientific Publications.
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : LAMI Raphaël, TEYSSEDRE Anne (3 décembre 2019), Dialogues et coopération chez les bactéries, Encyclopédie de l’Environnement. Consulté le 27 juillet 2024 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/vivant/dialogues-et-cooperation-chez-les-bacteries/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.







