细菌中的交互与协同作用

社交和合作是动物的特权吗?当然不是,植物和单细胞生物(如细菌)之间也存在。对于后者,社会行为特别依赖于局部的个体密度。费氏弧菌和其他物种一样,拥有一种依赖于密度的交流系统,称为“群体感应”,这使它们能够在高细胞密度下调节行为活动与协作。这个系统是如何运作的?是如何演变的?在细菌中广泛存在吗?在其他微生物中也存在吗?宿主物种对致病菌群体感应的反应是什么?对群体感应机制的理解能否帮助微生物学家控制微生物攻击,比如致病细菌形成的生物膜?这些是19世纪末20世纪初以来进化生物学和微生物学研究人员探索的一些问题。
1. 宿主-微生物组合:一个复杂的生态系统
无论是植物、动物、藻类还是真菌,所有的多细胞生物(或者说我们能用肉眼分辨的宏观生物)的表面和特定器官上都有大量的被称为“微生物群”的微生物群落,包括细菌、原生生物*(如变形虫和单细胞真菌),可能还有古菌*。宏观生物和微生物之间的这种联系对双方来说当然不是毫无用处,它们与宿主物种共存了许多代,微生物群的一些或所有生物可以为宿主的生理功能(也称为“宏生物”)做出重大贡献,从而建立相互的依赖或共生关系*(见《共生和寄生》)这也是人类肠道菌群的例子,朱莉娅•恩德斯(Giulia Enders)凭借《肠子的小心思》一书广为人知 [1],在本百科全书的另一篇文章中也提到了(见《人类微生物群:我们健康的盟友》)。
因此,宿主和微生物群在某种程度上是共生的。如果这种关系并非对双方都有利,那主要是因为,与宿主不同,微生物群并非由单个细胞分裂产生,它既不是一个单独的有机体,也不是一个相互协调的“超级有机体”。微生物细胞属于许多不同的物种,涉及多种生态和代谢关系,包括它们自身之间和与宿主之间。它们在外部环境中合成、降解和分泌许多化合物,这些化合物对周围的其它细胞以及宿主都有不同的影响。它们可以通过化学信号(称为信息素)相互交流,并通过聚集分子工具(如“消化酶”)进行协作;但也会通过释放有毒化合物来相互争斗 [2]。这些活动通常会稳定宿主和其微生物群之间的共生关系*,但有时也会导致后者对其宿主有规律的攻击!
该领域近二十年来的研究表明,微生物群细胞之间的“分子交互”极为复杂。根据“群体感应”的机制,在细菌发出的化学信号/信息中,一些信号只在特定条件(密度)下才会刺激细菌同其他细菌协作。从应用于医学和公共卫生的微生物学角度来看,了解这种有条件协作所涉及的机制可以开辟广阔的前景,例如:这种协作往往会提高有关细菌种群的毒性(见下文)。更广泛来讲,在理论和进化水平上,研究细菌群体问题和其感应机制的,可以探究细菌协作的进化问题 [3]。
2. 历史模型:乌贼的生物荧光细菌
生物体产生光的现象,让陆地和海洋的“外行”观察者和生物学家都一样着迷,这种现象被称为“生物荧光”。科学家通过在夏威夷发现的小型乌贼(或耳乌贼属,图1)详细研究了这种现象[4]。这只乌贼的外套膜上散布着多个小型发光器官,这些器官被称为“发光器”,其活动会根据局部光线、背部或腹部的位置以及乌贼的行为而变化。

乌贼在月光下捕猎时,发光器会将发光强度调至最高,这样可以弥补腹部表面的光线不足,并掩盖其投射的阴影。乌贼发出光,反倒在敌人、捕食者和猎物面前隐藏了它的存在[4]。这是非常有适应性的行为!但发光器中的发光细胞不属于乌贼:它们其实是一种可以发出生物荧光的费氏弧菌共生细菌[5],能够在宿主的神经内分泌系统控制下协调它们的光生产,并促进宿主的胚胎发育[4]。细菌这种行为增加了宿主的生存几率和繁殖成功率,从而增加了自身的选择价值!
20世纪70年代早期的研究表明,费氏弧菌只在浓度达到临界值或细菌能够检测到时才能合成发光所需的荧光素酶[5]。这种现象被称为群体感应,指(化学)细菌细胞数量间,或其他微生物之间借助通讯系统互相交流获悉局部密度,达到特定阈值后开展和协调集体活动的行为(见《细谈群体感应和化学信使》)然后,细菌表现出协作或“社会”行为,并能够在微生物细胞群体的层次同步表达特定功能。在乌贼的共生细菌例子中,受到控制的功能就是产生光(生物荧光)。
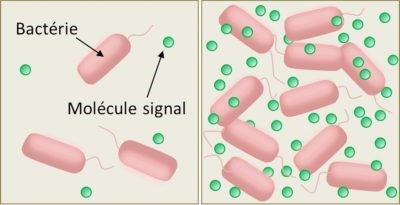
左图:培养基中有少量细菌时,信号分子浓度较低。
右图:培养基中有大量细菌时,信号分子浓度较高。高浓度的信号分子会诱导特定基因表达。(图2:Bactérie 细菌;Molécule signal 信号分子)
其机理相当简单。有群体感应能力的细菌合成有机分子并释放到外部环境,这些有机分子充当化学信号(信息素),而细菌自身对这些化学信号也很敏感(图2)。化学信号与细胞特异性受体(细胞膜或细胞内受体,视种类而定)结合,刺激信息素的合成与分泌,从而提高细胞外介质中信号分子的局部浓度——这一过程被称为自我诱导或自我训练。所以微生物学家将群体感应的化学信号称作“自我感应”。化学信号的局部浓度会随细菌的密度而变化(图2)。
细胞密度较低时,信号分子浓度非常低,很少能在其被降解或因局部扩散被消除前检测到;因此,此时细胞的功能模式(或表型)保持稳定,属于“个人主义”类型。一旦细胞密度达到一定阈值,在自我诱导环路的作用下,这些分子的局部浓度会将细胞切换到另一种功能模式,合成对整个群体有用的分子,并促进分子间的协调:即所谓的“社会”或“协作”型。
3. 群体感应的多种用途
20世纪80年代以来,人们在大量细菌中验证了它们可以利用群体感应来同步和协调集体活动(见注释[2][3])。在古菌和一些酵母菌真菌中也发现了两种不同的生长模式(菌丝或芽殖)(见注释[6][7])。
群体感应控制着微生物的许多功能,对微生物群的功能和宿主的生理产生重要影响(见注释[2][6])。例如,许多研究小组正在研究群体感应在某些弧菌(属牡蛎微生物群)中的作用,某些条件下这些弧菌可能会致病。
3.1 致病性
许多微生物通过群体感应来调控致病性:比如寄生于植物(欧文氏菌)或哺乳动物皮肤(如金黄色葡萄球菌)的致病菌、霍乱病原体(霍乱弧菌),可能还有真菌白色念珠菌。在其他细菌中,如大肠杆菌和克伦氏菌,群体感应控制着抗菌分子的酶(特别是内酯酶*)的产生和分泌,提供对抗生素的集体耐药性。
3.2 生物膜的形成
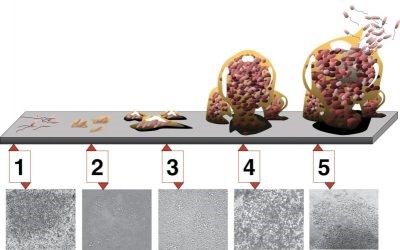
步骤1:初步附着;步骤2:不可逆附着;步骤3:生物膜的外观和一阶段成熟;第四步:二阶段成熟;第五步:侵蚀和扩散/自体分离。这些显微照片(大小相同)是正在形成的铜绿假单胞菌生物膜。来源;D.戴維斯(D. Davis)[CC BY 2.5]
群体感应还参与了细菌种群的绝缘和保护性生物膜的形成(图3),在这种生物膜下,细胞可以利用宿主或矿物质更有效地繁殖和协作:生物膜既能堵塞管道,也能覆盖牙齿钙化成牙垢,还能粘附在船壳上……群体感应也是囊性纤维化患者慢性感染的源头(假单胞菌感染)。
4. 群体感应的进化与适应
那么如何解释许多生活在微生物群落等孤立栖息地的细菌、古菌和其他微生物中存在这种社会交流系统且不断进化呢?从生态学、遗传学和进化的角度可以得出,在营养丰富的当地栖息地形成了密集的微生物群落,再加上微生物的基本运作方式(进食、繁殖、防御、交流等),共同推动了这些系统的进化。
密度。一般来说,微生物群中细胞的密度可以增加物种之间以及同一物种种群内化学和生物物理相互作用的频率和多样性。这些相互作用对个体可能有利,也可能有害(就选择价值而言)。因此,它鼓励在这些相互作用的基础上进化出多种交流系统,致力于协作,或者相反,致力于避开生态伙伴[8][9]。
隔离。无论是局限于宿主的某个器官,还是集中在某个营养源周围,微生物群落的(即使是相对)隔离都会增加同一“物种”的本局部种群近亲繁殖——就细菌而言,“近亲”指个体克隆产生的种群——从而促进了这些局部种群中社会行为的进化[10][11]。
在更高的整合层次上,微生物群的细胞是其生态系统的工程师:
- 它们的局部密度很高,通过多种代谢活动,它们显著改变了了其生物物理化学环境(就其宿主的规模而言)。
- 反过来,大量细胞集体活动引起的环境变化也促进了高密度条件下个体适应性社会行为的出现、进化和控制[2][3]。
就像物种的所有物种特征行为或物种中某些类别的个体(例如幼体,或动物中繁殖的成年个体)的特征行为一样,交流信号和社会行为只有在提高了这些行为的主体的包容性选择价值时才会进化,例如狼的集体狩猎或狐獴的集体防御。这两种行为都只涉及成年和亚成年个体(其中大多数与群体中的幼崽有亲缘关系)。由群体感应控制的细菌活动也是如此……只是数量规模不同!
为了在其宿主-耳乌贼的规模上(或在耳乌贼-细菌共生功能体规模上)起到作用,费氏梭菌的光辐射必须是大规模且同步的。然而,荧光素酶的合成和光辐射涉及的反应链是非常消耗能量的生理活动,当它们不起作用时(如在细菌数量少或/和协调不良的情况下)会收到负反馈(适应性的)。简而言之,这些活动只在特定密度条件下才适合细菌。
同样,细菌在“社会”模式下合成并向外部环境分泌能量密集型大分子,如酶、多糖、铁载体和其它对群体有用的“分子工具”,只有当分泌细菌被许多作用方式相同(通常来自同一克隆)的细胞包围时,分泌细菌才会受益(就包容性选择价值而言*)。换句话说,这些活动是在生产并向其它细胞提供生产成本高昂的“公共物品”(见参考文献[2]),且只在有来无往的情况下才能反向选择。
在这种情况下,只有自然选择能够促进这个交流和相互刺激的系统,让潜在的协作者通过发射和检测小信号分子相互了解局部密度,并在高密度下协作。简而言之,只有在生物条件(遗传、生态)有利于参与者时,群体感应才能让细菌合作……除非系统被劫持!
5. 信号的转移和利用
和动植物一样,在微生物中,任何通信系统只有在促进双方或多方(生殖伙伴、社会同族、生态伙伴、食物或性竞争对手等)之间的功能性互动,且对每方都有利的情况下才能出现和进化[9][10]。通信伙伴可以被称为信号的发送者和“生物接收者”。
然而,生物信号发送者和接收者并非独占它们的栖息地:它们与许多其它生物体生活在一起。这些生物是潜在的探测器,也是在场物种以化学、视觉、声音和其他表现形式所传递的所有信息(和潜在物质资源)的使用者。例如,一只雄性夜莺栖息在树枝上,它的歌声不仅会被捕猎的貂和人类听到,也会被它的同类(当前或潜在的性伴侣、性对手等)听到。
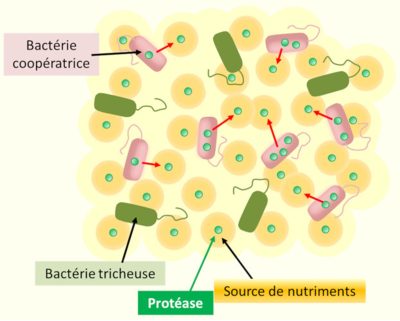
向周围环境分泌(红色箭头指示)依赖于群体感应的公共产品(这是一种蛋白酶,可以产生细菌生长所需的营养物质),需要协作的细菌细胞付出代价——尤其是能量。环境中的作弊细胞并不分泌这些酶,而是免费利用产生的营养物质。因此,它们从细菌的协作中获益,并在混合种群中恢复优势。(图4 Bactérie coopératrice 细菌协作;Bactérie tricheuse 细菌毛状体;Protéase 蛋白酶;Source de nutriments 营养来源 )
在物种的正常生活条件下,信号的发射只有在其对所有能够感知并作出反应的生物体产生影响(无论它们是否是功能性伙伴),并且对发射者有利时才会进化。这并不排除共享同一栖息地的其他生物探测、利用和/或转移信号的可能,尽管这并非它们的本意。这当然也适用于细菌群体感应。
突变菌株的存在,是由于其对来自同族的群体感应信号不敏感,多个物种已证实了这一点。这些个人主义突变体无需进行高能耗的“社会性”同源物合成,却受益于后者释放到外部环境中的酶活性和分子工具(称为“公共产品”),因此它们在短期内比其社会性同源物更有竞争力,且最初会在种群中传播。换句话说,它们是“作弊者”,寄生在一个它们并不参与的交流与协作的系统中(图4)[12]。
然而,这些“作弊者”的比例不断增加,逐渐降低了局部社交模式下细胞的密度。因此,它们降低了群体的生产力(阻碍了局部群体的集体功能)和群体感应信号的密度,最终结束了局部合作 [13]。
[图源:美国疾病防控中心(CDC), 珍妮丝·哈尼·卡尔(Janice Haney Carr)(公共领域)]
因此,在实验室中,对群体感应化学信号不敏感的突变体入侵铜绿假单胞菌(图5)后,会降低细菌在社会模式下形成的保护性生物膜的厚度,增加局部对抗生素的敏感性,并降低“野生”细菌(即潜在的社会性细菌)对群体感应的反应。此外,这种反应与参与实验的细菌的亲缘关系(遗传邻近性)相反:根据汉密尔顿规则*,遗传距离会减少个体间的协作。
利用细菌发出的群体感应信号,当然不是这些信号不敏感的“作弊”突变体的专属,这些突变体在细菌系中时有发生。理论上讲,只要这种使用能够提高使用者的平均繁殖成功率(或者,更准确地说,是包容性适合度*),自然选择就会倾向于任何频繁出现在同一栖息地、可能感知到这种信号的物种。宿主物种本身也使用这种信号。这使得外界可以利用现有的通信系统,系统的进化反过来又会对信号的生物发射器和/或接收者施加选择压力(见[9][10]和下文)。
6. 操纵分子交互
参与群体感应控制的化合物控制着对人体有害的微生物的许多功能,如致病性或形成生物膜的能力。许多研究小组致力于操纵这些分子交互来控制、限制或阻止这些微生物活动。随着微生物对已知抗生素的耐药性越来越强,面临的挑战也变得越来越大。因此,寻找替代控制策略至关重要。
为了实现这一目标,研究人员(以仿生和/或进化的方法)从自然界中观察到的信号利用策略中汲取灵感。我们知道,许多物种,特别是宿主,能够抑制微生物细胞间的群体感应分子交互:这种现象被称为群体猝灭。
信号的发射只有在它对所有能够感知并对其作出反应的生物体产生影响(无论它们是否是功能性伙伴),并且在物种正常的生活条件下对发射者有利时才会进化。这并不排除共享同一栖息地的其他生物探测、利用和/或可能转移信号,而这并非它们的本意。这当然也适用于细菌群体感应。

右图:© 狄德罗(Daderot)[CC0],维基百科共享。左图:巴纽尔斯-索邦大学天文台。
一个最著名的例子是澳大利亚研究人员对红色藻类Delisea pulchra(图6)的发现。这种红藻释放的分子与寄生在其表面的细菌发出的群体感应信号非常相似(称为呋喃酮的类似化合物),这种分子不但不会激活目标细菌的生物反应,反而会使其失活。通过这种行为,藻类可以对抗其叶片表面生物膜和致病菌的生长[14]。这些类似化合物现在正作为防污剂(生物杀菌剂)进行测试,实验室正试图对它们进行化学改性,使其更加有效。类似的策略也在各种各样的其他环境中进行测试,以控制植物和藻类病原体。
因此,群体猝灭的应用是多种多样的,许多仍处于实验阶段。一些团队已经使用芽孢杆菌来控制水产养殖中的鱼类病原体[15]。这些细菌分泌酶来降解群体感应信号。它们以小球的形式加入到鱼饲料中,通过降解控制病原体协调的化学信号,可以控制水产养殖池或水族馆中的病原体。其他人也在尝试类似的策略来控制工业过滤膜上形成的生物膜[16]。
在医学界,有些领域前景似乎尤为广阔。众所周知,抗生素能显著改变我们的肠道菌群。诱发的失衡可能导致出现某些病原体和疾病。但最近的一项研究[17]表明,向老鼠肠道注射过量产生群体感应分子(AI-2)的细菌,有助于控制其肠道的微生物种群。因此,在对微生物群有害的抗生素治疗后,注射这种菌株可以找到更多样化的微生物群,特别是富含厚壁菌门的微生物群。
7. 合作还是不合作?这是一个问题
有人说,团结就是力量。这句格言在我们人类眼中几乎是不言而喻的:人类伙伴或盟友之间的社会行为、合作和组织使几个人能够采取对所有参与者都有利的行动,这些行动是独立的个体无法单独完成的。
然而,即使是在这个领域出类拔萃的动物王国,合作也不是黄金法则。与天鹅和大多数鸟类不同,绿头鸭独自抚养幼鸭。狮子的近亲老虎是独自狩猎的。尽管蜜蜂具有高度的社会性,但许多种类的蜜蜂是独居的……我们必须认识到并质疑物理、生物和社会环境在“利他”行为和交流进化中的多重作用[18]。微生物也是如此。
合作总是涉及到成本和风险,尤其是涉及到通信信号的发射和非接收生物(如竞争者、捕食者、寄生虫)发现这些信号的成本和风险,因为这些生物并不倾向于合作[9][10]。因此,社会行为和合作只有在利益(就选择价值而言,即将基因传递给后代)超过这些成本的情况下才能进化。因此,许多细菌群体感应的进化,可以根据宿主防御的有效性和/或微生物环境,从对宿主无害转变为致病性;因此,在通过群体感应控制协作的细菌群体中,对社会信号不敏感的“作弊者”会偶尔但短期地扩张;因此,在这些细菌的宿主或竞争物种中会进化出“群体猝灭”。
8. 一个可供多个领域探索的系统!
微生物相互作用的研究是一个不断发展的研究课题。所涉及的化学信号的特性和它们所控制的微生物功能的鉴定仍然是当前研究的挑战。除医学研究外,进化生物学和生态学研究关于群体感应的研究表明,这种有条件的合作系统在共生进化和“微生物”与其宿主之间的其他相互作用,以及微生物群落对当前环境变化的适应中发挥着重要作用。因此,对这一系统的研究在环境科学中可以发挥关键作用,支持生态转型。
9. 总结
- 群体感应是细菌社会行为的关键机制之一,它基于细胞释放和检测小信号分子或“关键分子”,这些小信号分子在外界环境中的浓度随细菌浓度的增加而增加。
- 在外部环境中,当浓度超过一定阈值时,这些关键分子会使细胞切换到另一种合作模式。
- 每个“物种”或菌株的特征不同,群体感应的分子信号是非常多样化的。
- 这种机制并非特别针对细菌:最近该机制在其他微生物、原生生物和古菌中也得到了证实。
- 从理论和进化的角度来看,对群体感应的研究可以探索细菌和其他微生物社会行为的进化,以及它们与宿主之间相互作用的进化——尤其是共生关系。
- 群体感应已在具有医学意义的菌株上得到广泛研究,并开始用于限制对人类有害的细菌活动。
参考资料和说明
封面图片。小乌贼(夏威夷短尾鱿鱼)(来源:克里斯·弗雷泽(Chris Frazee)和玛格丽特·麦克法利(Margaret McFall)[CC BY 4.0])。
[1] Enders G. (2015). Gut: The Inside Story of Our Body’s Most Underrated Organ. Greystone Books; translated from the original book in german by Enders G. (2014) Darm mit Charme : Alles über ein unterschätztes Organ, Ullstein, Berlin.
[2] West S.A., Diggle S.P. et al., 2007. The social live of microbes. Annu. Rev. Ecol. Evol. Syst. 38:53–77.
[3] Diggle S.B. et al., 2007. Evolutionary theory of bacterial quorum sensing – When is a signal not a signal ? Phil. Trans. R. Soc. B 362:1241-1249.
[4] McFall-Ngai M., 2014. Dividing the essence of Symbiosis: Insights from the squid-Vibrio Model. PLOS Biology 12(2): e1001783, doi:10.1371/journal.pbio.1001783.
[5] Nealson K., Platt T. & Hastings J.W., 1970. The cellular control of the synthesis and activity of the bacterial luminescent system. Journal of Bacteriology 104 (1):313–22.
[6] Albuquerque P. & Casadevall A., 2012. Quorum sensing in fungi – a review. Medical Mycology 50:337–345.
[7] Zhang F., 2012. Acyl homoserine lactone-based quorum sensing in a methanogenic archaeon. ISME Journal 6:1336–1344.
[8] Teyssèdre A., 1993. La Communication animale, sur la scène de l’évolution. Paris, Nathan ; Teyssèdre A., 2006. Les clefs de la communication animale. Paris, Delachaux et Niestlé.
[9] Maynard Smith J. & Harper D., 2003. Animal signals. New York, Oxford University Press.
[10] Hamilton, W. D. 1964. Genetical evolution of social behaviour I. J. Theor. Biol. 7:1–16.
[11] Maynard Smith J., 1989. Evolutionary Genetics. New York, Oxford University Press.
[12] Diggle S.P., Griffin A.S. et al., 2007. Cooperation and conflict in quorum sensing bacterial populations. Nature 450:411-414.
[13] Popat R., Crusz S.A. et al., 2012. Quorum-sensing and cheating in bacterial biofilms. Proc. R. Soc. B 279:4765–4771.
[14] Rasmussen T.B., Manefield M., Andersen J.B., Eberl L., Anthoni U., Christophersen C. et al., 2000. How Delisea pulchra furanones affect quorum sensing and swarming motility in Serratia liquefaciens MG1. Microbiology 146(12):3237-3244
[15] Defoirdt T., Sorgeloos P. & Bossier P., 2011. Alternatives to antibiotics for the control of bacterial disease in aquaculture. Current opinion in microbiology 14(3): 251-258.
[16] Oh H.S., Yeon K.M., Yang C.S., Kim S.R., Lee C.H., Park S.Y. et al., 2012. Control of membrane biofouling in MBR for wastewater treatment by quorum quenching bacteria encapsulated in microporous membrane. Environmental Science & Technology 46(9): 4877-4884.
[17] Thompson J.A., Oliveira R.A., Djukovic A., Ubeda C. & Xavier K.B., 2015. Manipulation of the quorum sensing signal AI-2 affects the antibiotic-treated gut microbiota. Cell reports 10(11):1861-1871.
[18] Krebbs J.R. & Davies N.N. (Eds), 1991, 1997. Behavioural Ecology. Oxford, Black Well Scientific Publications.
环境百科全书由环境和能源百科全书协会出版 (www.a3e.fr),该协会与格勒诺布尔阿尔卑斯大学和格勒诺布尔INP有合同关系,并由法国科学院赞助。
引用这篇文章: LAMI Raphaël, TEYSSEDRE Anne (2024年3月13日), 细菌中的交互与协同作用, 环境百科全书,咨询于 2024年7月27日 [在线ISSN 2555-0950]网址: https://www.encyclopedie-environnement.org/zh/vivant-zh/what-is-nature-2/.
环境百科全书中的文章是根据知识共享BY-NC-SA许可条款提供的,该许可授权复制的条件是:引用来源,不作商业使用,共享相同的初始条件,并且在每次重复使用或分发时复制知识共享BY-NC-SA许可声明。









