Chauves-souris et émergence des coronavirus
PDF1. La plupart des coronavirus connus proviennent des chauves-souris

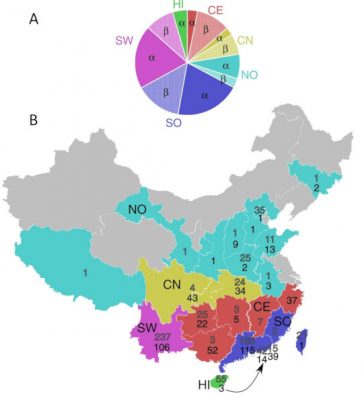
Dans le cas de l’épidémie de SRAS en 2002 – 2003, la Civette masquée et le chien viverrin (Nyctereutes procyonoides) avaient été identifiés comme les animaux ayant transmis le coronavirus (SARS-CoV-1) aux êtres humains. Ce n’est que bien plus tard que les chercheurs ont découvert que ce coronavirus avait pour origine des hôtes chauves-souris appartenant aux espèces du genre Rhinolophus, notamment Rhinolophus sinicus, R. ferrumequinum, R. affinis, R. macrotis, R. monoceros, R. pearsoni et R. pusillus (Figure 1) On a même localisé l’origine géographique de ces virus dans une grotte reculée de la province du Yunnan, dans le sud-ouest de la Chine.
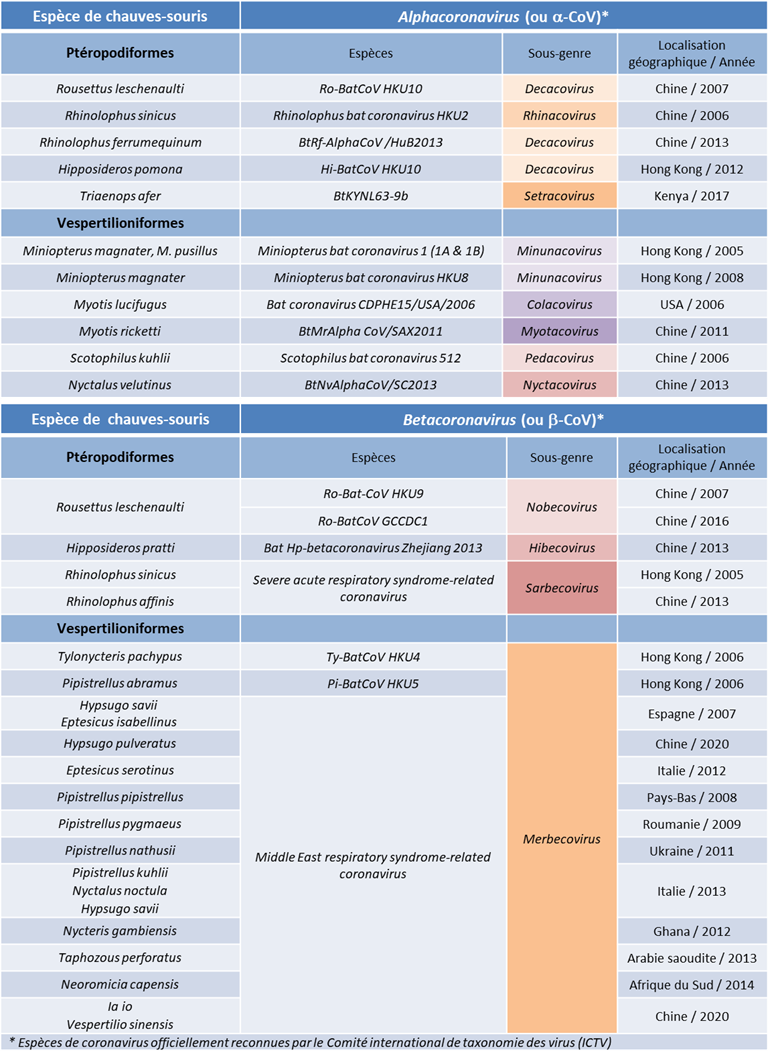
Tableau. Coronavirus de chauves-souris dont certains sont à l’origine d’espèces responsables d’épidémies récentes.
Civette masquée et chien viverrin ont donc joué le rôle d’hôtes intermédiaires entre les chauves-souris et les humains dans la transmission. La recherche du virus s’étant avérée négative chez les civettes vivant en milieu sauvage, ce sont vraisemblablement les activités humaines d’élevage, de vente sur les marchés et de consommation dans les restaurants de ces animaux qui ont favorisé les contaminations entre animaux sauvages et humains.
2. Où l’épidémie de COVID-19 a-t-elle démarré ?

Le patient zéro reste donc à trouver. Le connaîtrons-nous un jour ? Si la maladie est datée officiellement à fin décembre 2019, les analyses font état de malades dans la région de Wuhan dès mars 2019 ! En France, des cas de COVID-19 auraient pu être déjà présents à la mi-novembre 2019. On en vient à penser que la première infection d’un être humain remonte sans doute à plusieurs années. Des études ont montré que les transferts viraux entre faune sauvage et humains sont beaucoup plus fréquents que ce que l’on pensait et passent souvent inaperçus. Dans le cas de la COVID-19, il s’agit probablement d’un événement unique de transmission de l’animal à l’homme qui a réussi il y a un certain temps.
3. Origine du coronavirus SARS-CoV-2 ?
- Deux génomes sont identiques entre eux à 97 % et proviennent de virus de chauves-souris de l’espèce Rhinolophus sinicus collectées en 2015 et 2017 dans la province du Zhejiang. Ils présentent 89 % de similarité avec le SARS-CoV-2 [3].
- Le troisième génome viral dénommé BatCoV RaTG13, est beaucoup plus proche du SARS-CoV-2 puisqu’il présente une homologie de séquence de 96,2 %. Ce virus a été isolé en 2013 chez une chauve-souris du même genre que précédemment mais appartenant à une espèce différente affinis, récupérée dans une mine abandonnée de la province du Yunnan [4].
Même si ce pourcentage d’homologie semble élevé, on ne peut pas pour autant confondre les deux coronavirus BatCoV RaTG13 et SARS-CoV-2 qui ont certainement eu un ancêtre commun dont on estime la séparation il y a de 40 à 70 ans [5]. Tout récemment, en réanalysant le génome d’un coronavirus appelé Ro-BatCoV HKU9 isolé en 2011 d’une Roussette de Leschenault (Rousettus leschenaulti) de la région du Guangdong, les chercheurs ont été interpellés par le fait qu’en recombinant les deux virus RaTG13 et HKU9, un virus très similaire au SARS-CoV-2 se dégageait [6]. Il n’est pas impossible que des roussettes et des rhinolophes cohabitant au sein des mêmes grottes du sud de la Chine aient pu s’échanger leurs coronavirus qui à leur tour ont partagé des séquences de leurs génomes pour engendrer un virus recombiné proche du SARS-CoV-2.
Cependant, un mystère subsiste : comment le SARS-CoV-2 a pu se retrouver à Wuhan dans la province du Hubei, pourtant très éloignée des provinces précédemment citées du sud de la Chine ? Mystère d’autant plus épais que les campagnes de surveillance virale, menées depuis quelques années chez les chauves-souris du Hubei, n’ont pas permis d’isoler des virus apparentés au SARS-CoV.
4. Quelles ont été les circonstances de transmission du coronavirus pathogène aux humains ?
4.1. Une contamination directe ?
La contamination a pu se faire directement lors des activités de chasse dont les chauves-souris sont l’objet. Les chasseurs s’introduisent dans les grottes et peuvent se contaminer au contact des fèces et aérosols générés par elles. La contamination peut également se faire lors de la manipulation ou du transport des cadavres de chauves-souris, ou encore lors de la découpe de cette viande de brousse. Cependant, si les grandes roussettes constituent un mets très apprécié, cela ne semble pas être le cas pour les rhinolophes trop petits pour faire un repas convenable. On ne peut toutefois exclure cette éventualité.
L’hypothèse de la transmission directe du virus aux êtres humains a été confortée par des études de séroprévalence qui ont montré la présence d’anticorps anti-coronavirus de chauves-souris dans le sang d’un pourcentage non négligeable d’habitants des zones rurales du sud de la Chine. Ces résultats suggèrent que des échanges de coronavirus ont bien lieu entre les habitants et les chauves-souris regroupées en colonies dans des grottes situées à proximité des villages [7].
4.2. Des hôtes intermédiaires ?

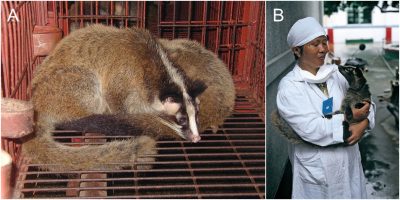
Se nourrir directement de cadavres de chauves-souris pourrait être le fait de petits animaux carnivores comme la Civette masquée ou le chien viverrin, déjà connus comme porteurs du SARS-CoV-1, mais aussi les blaireaux d’Asie (Meles leucurus) et les blaireaux-furets (Melogale moschata). N’avons-nous pas écarté un peu vite un suspect évident, la Civette masquée [3] (Figure 5) ? Les Chinois en sont très friands et cet animal fait depuis longtemps l’objet d’élevages intensifs qui devaient être mis sous contrôle depuis l’épidémie de SRAS de 2002. Qu’en est-il des mesures prises pour les élevages actuels ? Nous ne disposons que de peu d’informations.
Pour conclure, on constate que l’origine du SARS-CoV-2 fait pour l’instant l’objet de beaucoup de spéculations. Rappelons qu’il a fallu quinze ans pour identifier le virus de chauve-souris à l’origine de l’épidémie de SRAS de 2002. Il est fort probable que les découvertes à venir confirmeront le rôle des chauves-souris dans l’origine de la COVID-19 [11]. Toutefois, il faut bien comprendre que ces liens entre chauves-souris et virus ne viennent pas de s’établir ; ils peuvent être très anciens. Ce n’est pas parce que cette relation vient d’émerger à notre connaissance qu’elle représente une plus grande menace maintenant qu’auparavant.
5. Messages à retenir
- La plupart des coronavirus connus sont issus de chauves-souris de Chine.
- Les coronavirus responsables du SRAS ont pour origine des hôtes chauves-souris appartenant au genre Rhinolophus. Des mutations ont rendu contagieux ces virus chez les êtres humains après une transmission directe ou via des hôtes intermédiaires.
- Pour le SARS-CoV-2 responsable de la pandémie de COVID-19 chez les humains, la chaîne de transmission fait encore l’objet de beaucoup de spéculations.
- Les liens chauves-souris/virus qui viennent d’émerger à notre connaissance ne représentent pas pour autant une plus grande menace maintenant qu’auparavant.
- Pour parer à de nouvelles épidémies, il faut impérativement agir sur les facteurs de risque qui exposent êtres humains et faune sauvage.
Remerciements à François Moutou et au photographe Louis-Marie Préau (www.louismariepreau.com) pour leurs contributions à cet article.
Notes et références
Photo vignette. Grand rhinolophe. [Source : © ML Préau, www.louismariepreau.com]
[1] Zhan SH, Deverman BE, Chan YA. (2020). SARS-CoV-2 is well adapted for humans. What does this mean for re-emergence ? bioRxiv preprint <doi: https://doi.org/10.1101/2020.05.01.073262>.
[2] Latinne A, Hu B, Olival KJ, Zhu G, Zhang L, Li H, Chmura AA, Field HE, Zambrana-Torrelio C, Epstein JH, Li B, Zhang W, Wang LF, Shi ZL, Daszak P. (2020). Origin and cross-species transmission of bat coronaviruses in China. Nat Commun 11 (1), 4235. https://doi.org/10.1038/s41467-020-17687-3
[3] Li C, Yang Y, Ren L. (2020). Genetic evolution analysis of 2019 novel coronavirus and coronavirus from other species. Infect Genet Evol, 82, 104285. <doi: 10.1016/j.meegid.2020.104285>.
[4] Zhou P, Yang XL, Wang XG, Hu B, Zhang L, Zhang W, Si HR, Zhu Y, Li B, Huang CL, Chen HD, Chen J, Luo Y, Guo H, Jiang RD, Liu MQ, Chen Y, Shen XR, Wang X, Zheng XS, Zhao K, Chen QJ, Deng F, Liu LL, Yan B, Zhan FX, Wang YY, Xiao GF, Shi ZL. (2020). A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature, 579 (7798), 270-273. <doi: 10.1038/s41586-020-2012-7>.
[5] Boni MF, Lemey P, Jiang X, Lam TT-Y, Perry BW, Castoe TA, Rambaut A, Robertson DL. (2020). Evolutionary origins of the SARS-CoV-2 sarbecovirus lineage responsible for the COVID-19 pandemic. Nat Microbiol. <doi: 10.1038/s41564-020-0771-4>.
[6] Lau SK, Poon RW, Wong BH, Wang M, Huang Y, Xu H, Guo R, Li KS, Gao K, Chan KH, Zheng BJ, Woo PC, Yuen KY. (2010). Coexistence of different genotypes in the same bat and serological characterization of Rousettus bat coronavirus HKU9 belonging to a novel Betacoronavirus subgroup. J Virol, 84 (21),11385-11394. <doi: 10.1128/JVI.01121-10>.
[7] Li H, Mendelsohn E, Zong C, Zhang W, Hagan E, Wang N, Li S, Yan H, Huang H, Zhu G, Ross N, Chmura A, Terry P, Fielder M, Miller M, Shi Z, Daszak P. (2019). Human-animal interactions and bat coronavirus spillover potential among rural residents in Southern China. Biosaf Health, 1 (2), 84-90. <doi: 10.1016/j.bsheal.2019.10.004. Epub 2019 Nov 9>.
[8] Li X, Giorgi EE, Marichann MH, Foley B, Xiao C, Kong X-P, Chen Y, Korber B, Gao F. (2020). Emergence of SARS-CoV-2 through Recombination and Strong Purifying Selection. bioRxiv. preprint <doi: 10.1101/2020.03.20.000885>.
[9] Lee J, Hughes T, Lee M-H, Field H, Rovie-Ryan J J, Sitam, F T, Sipangkui S, Nathan S K.S.S, Ramirez Diana, Kumar S V, Lasimbang H, Epstein J H, Daszak P. (2020). No evidence of coronaviruses or other potentially zoonotic viruses in Sunda pangolins (Manis javanica) entering the wildlife trade via Malaysia. bioRxiv 2020.06.19.158717; doi: https://doi.org/10.1101/2020.06.19.158717
[10] Leroy EM, Ar Gouilh M, Brugère-Picoux J. (2020). The risk of SARS-CoV-2 transmission to pets and other wild and domestic animals strongly mandates a one-health strategy to control the COVID-19 pandemic. One Health, 100133. <doi: 10.1016/j.onehlt.2020.100133>.
[11] Ar Gouilh M, Puechmaille SJ, Diancourt L, Vandenbogaert M, Serra-Cobo J, Roïg ML, Brown P, Moutou F, Caro V, Vabret A, Manuguerra JC, EPICOREM consortium. (2018). SARS-CoV related Betacoronavirus and diverse Alphacoronavirus members found in western old-world. Virology, 517, 88-97. <doi: 10.1016/j.virol.2018.01.014>.