Chauves-souris et virus ou comment cohabiter en harmonie
PDF
Longtemps ignorées, voire méprisées, les chauves-souris sont l’objet depuis quelques années d’une attention croissante du public et des chercheurs. Dotées de capacités exceptionnelles comme le vol et l’écholocation, elles intriguent les premiers. Leur longévité inattendue compte tenu de leur taille et surtout un système immunitaire unique leur permettant de tolérer bon nombre de virus mal supportés par les mammifères terrestres, en font d’excellents modèles d’étude pour les seconds. Cette image alors améliorée vient cependant se ternir par la connaissance de leurs liens avec les virus pathogènes. En effet, les chauves-souris semblent jouer un rôle crucial dans les épidémies à virus émergents qui secouent de plus en plus fréquemment la population mondiale depuis quelques années. La pandémie actuelle de COVID-19 ne fait pas exception, et a de nouveau propulsé les chauves-souris sur le devant de la scène. Cette situation suscite de nombreuses interrogations : en quoi les chauves-souris constituent des hôtes privilégiés pour les virus pathogènes ? Quel rôle ont-elles joué dans l’origine de la pandémie de COVID-19 ? Sont-elles bien responsables de l’émergence des nouvelles maladies virales qui touchent de plus en plus les êtres humains et les animaux domestiques ?
- 1. Les chauves-souris sous le feu de l’actualité
- 2. Chauves-souris et virus ?
- 3. Pourquoi les chauves-souris sont des hôtes privilégiés de virus pathogènes ?
- 3.1. La cohabitation virus/chauves-souris est ancienne
- 3.2. Une longue durée de coévolution entre virus et chauves-souris
- 3.3. Le vol, essentiel aux liens entre chauves-souris et virus
- 3.4. Respiration et stress oxydant
- 3.5. Une longévité exceptionnelle propice à la persistance des virus
- 3.6. Léthargie et torpeur
- 3.7. Importance de la vie en commun
- 3.8. Des capacités immunitaires uniques
- 4. Les chauves-souris sont-elles responsables des émergences virales ?
- 5. Messages à retenir
1. Les chauves-souris sous le feu de l’actualité
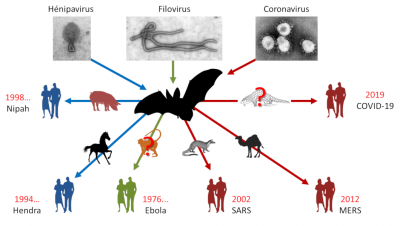
Le début de l’année 2020 a été marqué par l’émergence d’une maladie respiratoire qui s’est rapidement propagée dans la population mondiale à tel point qu’il a fallu admettre que les humains étaient en présence, après la pandémie relativement limitée de grippe A en 2009-2010, de la première pandémie majeure du XXIe siècle (Lire Les pandémies virales de l’ère moderne). Il s’avère que l’agent pathogène responsable de cette pandémie est un coronavirus, proche de celui qui a été à l’origine d’une épidémie d’infections respiratoires principalement localisées en Chine en 2002-2003. Ce dernier avait alors reçu le nom de coronavirus du syndrome respiratoire aigu sévère ou SARS-CoV (en anglais, severe acute respiratory syndrome). Il a dernièrement été renommé en SARS-CoV-1 pour le différencier du nouveau SARS-CoV-2, responsable de la maladie nommée par l’Organisation Mondiale de la Santé (OMS) COVID-19 pour COronaVIrus Disease 2019.
Comme pour le SARS-CoV-1, les chauves-souris semblent être impliquées dans la chaîne de transmission virale. En effet, des résultats préliminaires ont montré que le SARS-CoV-2 serait issu de la recombinaison d’un coronavirus de chauve-souris [1] avec un coronavirus de Pangolin malais (Manis javanica) [2]. Ce dernier, comme la Civette masquée (Paguma larvata) pour l’épidémie de 2002-2003, aurait joué le rôle d’hôte intermédiaire entre la chauve-souris et l’Homme pour donner naissance au SARS-CoV-2 qui s’avère très contagieux chez les êtres humains (Lire Focus Chauves-souris et émergence des coronavirus).
Ce n’est pas la première fois que les chauves-souris se retrouvent sous le feu de l’actualité. Il faut remonter à 1911 pour qu’une première mention soit faite d’un virus isolé chez des chauves-souris. A l’époque, on s’intéresse à la rage et on découvre qu’elle est transmise par les chauves-souris vampires communs du Brésil. Après une longue période d’oubli, on redécouvre durant les années 1990-2000 dans le cadre de programmes de surveillance sanitaire, que les chauves-souris sont les hôtes naturels de nombreux virus émergents tels que les hénipavirus (Hendra et Nipah), les filovirus (Ebola) et les coronavirus (SARS) [3] (Figure 1). De manière inattendue, on constate qu’elles ne sont pas affectées par la plupart de ces agents pathogènes. Démonstration est même faite, notamment pour les virus Hendra et Nipah, qu’elles peuvent résister à des charges virales qui sont normalement mortelles chez d’autres mammifères [4].
2. Chauves-souris et virus ?
2.1. Les chauves-souris représentent le quart des espèces de mammifères
Une révision récente de l’ordre des Chiroptères à partir de données moléculaires l’a refondu en deux nouveaux sous-ordres plus cohérents phylogénétiquement (Lire : Focus Chauves-souris et émergence des coronavirus) :

- Les Yinpterochiroptera (Ptéropodiformes) dont font notamment partie les roussettes tropicales ou renards volants (Figure 3) ;
- Les Yangochiroptera (Vespertilioniformes) qui inclut tous les microchiroptères à l’exception de cinq familles.
2.2. Une très grande variété de niches écologiques

2.3. Que sont les viromes de chauves-souris ?
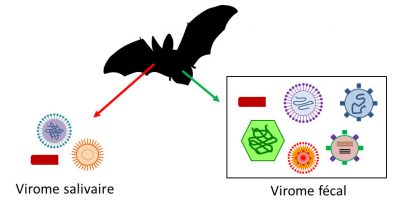
Grâce à ces prélèvements, un grand nombre de séquences virales ont ainsi pu être identifiées dont certaines se sont révélées être similaires à celles de nombreux virus connus comme pathogènes chez les êtres humains [6]. Néanmoins, attention à ne pas, comme cela a parfois été fait un peu vite, en conclure que les chauves-souris sont responsables de toutes les maladies virales qui affectent les êtres humains ! Si ces méthodes ont apporté des avancées significatives dans la connaissance des liens entre virus et chauves-souris, il faut toutefois rester prudent dans l’interprétation de la masse considérable de données obtenues compte tenu de la faiblesse des moyens d’analyse.
Cependant, il est étonnant de constater que l’ensemble de ces avancées est venu conforter de simples observations faites en 1974 qui révélaient déjà la propension des chauves-souris à être les hôtes d’une grande variété de virus à ARN et à ADN [7].
2.4. L’anagramme de « chauves-souris » est « souche à virus » ! Est-il justifié ?
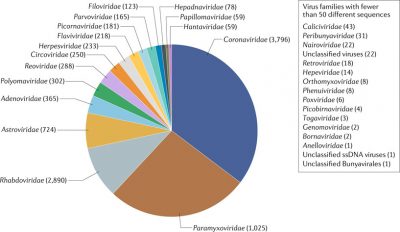
Concernant plus précisément les coronavirus, une autre vaste étude comparative [10] a été menée chez plus de 19 000 animaux appartenant aux chauves-souris, rongeurs et primates non-humains. Elle a montré que 98 % des coronavirus retrouvés provenaient des chauves-souris. Une présence massive et diverse puisque, sur cent types de coronavirus identifiés, 91 étaient issus des Chiroptères. La proportion d’individus positifs à un coronavirus était de 8,6 % chez les chauves-souris et de 0,2 % chez les autres animaux. En extrapolant ces résultats à l’ensemble des espèces de chauves-souris, elles seraient porteuses à travers le monde de pas moins de 3 200 coronavirus. Ce nombre a récemment été ré-évalué à 3 796 (Figure 6) [11]. Les chauves-souris semblent donc présenter des aptitudes particulières.
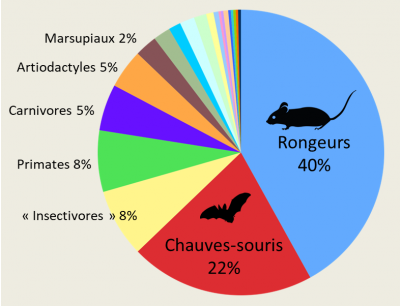
Néanmoins, tout ceci est à relativiser car il existe dans ces études des biais d’échantillonnage. L’ordre des Chiroptères avec ses 1 428 espèces occupant le deuxième rang chez les Mammifères, les chauves-souris se retrouvent forcément sur le devant de la scène. Récemment, des chercheurs ont montré qu’en allant au-delà des mammifères et en incluant les oiseaux, le risque de zoonoses virales reste homogène quelle que soit l’appartenance des espèces hôtes aux ordres aviens et mammaliens, et donc que le nombre de zoonoses par ordre taxinomique augmente en fonction de l’abondance en espèces [12]. Ainsi, pour les chauves-souris et les rongeurs, le nombre élevé de virus zoonotiques serait tout simplement relié à la richesse spécifique des deux ordres qu’ils représentent.
En réalité, les explications sur le rôle privilégié que jouent les chauves-souris dans les émergences virales sont plutôt à rechercher du côté de leur écoéthologie particulière, de leurs caractéristiques physiologiques et immunitaires inhabituelles mais aussi de leurs capacités à échanger des virus à ARN plus intensément que chez d’autres espèces animales. Enfin, il faut y ajouter la façon dont les humains par leur action sur les écosystèmes créent des conditions favorables pour mettre tous ces éléments en synergie.
3. Pourquoi les chauves-souris sont des hôtes privilégiés de virus pathogènes ?
3.1. La cohabitation virus/chauves-souris est ancienne

3.2. Une longue durée de coévolution entre virus et chauves-souris
Les virus ont ainsi disposé d’une très longue durée pour s’adapter à leurs hôtes Chiroptères et coévoluer intimement. Une lente sélection des capacités des virus à infecter leur hôte s’est opérée, engendrant une adaptation virale de plus en plus étroite à certaines molécules présentes à la surface des cellules de chauves-souris. Ces molécules jouant le rôle de récepteurs, elles vont avoir un rôle crucial dans la pénétration du virus dans les cellules de l’hôte. Etant par ailleurs engagées dans un certain nombre de processus physiologiques fondamentaux, ces molécules réceptrices sont restées hautement conservées dans le monde animal. Ceci explique l’aisance avec laquelle les virus se jouent des barrières d’espèces et circulent rapidement parmi les hôtes mammifères.
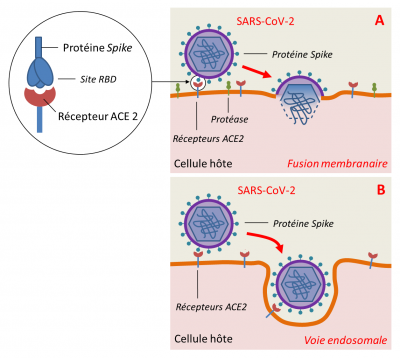
Cependant, il faut encore que la clé (protéine S) ait acquis par mutations une séquence particulière en acides aminés dans son domaine de fixation RBD (receptor binding domain) au récepteur ACE2 humain ainsi qu’un site spécifique de clivage par les enzymes de l’hôte pour que le SARS-CoV-2 puisse infecter les cellules humaines [14].
Ces mutations ont vraisemblablement été acquises par le coronavirus d’origine chauves-souris lors de passages par des hôtes intermédiaires pour aboutir au SARS-CoV-2. Outre l’être humain, ce dernier s’avère capable d’infecter d’autres mammifères comme les primates (singes Macaques), certaines espèces de cervidés et de cétacés, le chat domestique, le tigre, le hamster doré, le furet, le vison et le chien domestique. En dehors des Mammifères, les autres classes de Vertébrés ne semblent pas concernées [15].
3.3. Le vol, essentiel aux liens entre chauves-souris et virus

De manière plus inattendue, on s’est rendu compte que le vol, en accroissant fortement le métabolisme (15 à 16 fois par rapport aux 2 fois de la plupart des oiseaux) et la température corporelle de la chauve-souris (>38°C), induisait une réponse similaire à celle d’un état fiévreux. Or, la fièvre est un mécanisme naturel de défense utilisé par les animaux endothermes pour inhiber la croissance des agents pathogènes et stimuler leur immunité. Ainsi, en induisant un état fiévreux plus ou moins permanent, le vol contribuerait à rendre les chauves-souris plus résistantes aux attaques virales [16].
3.4. Respiration et stress oxydant
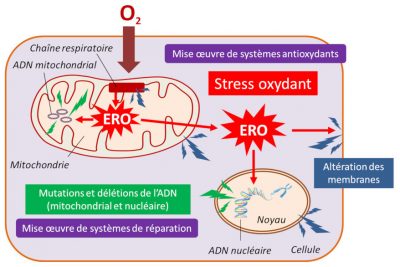
3.5. Une longévité exceptionnelle propice à la persistance des virus
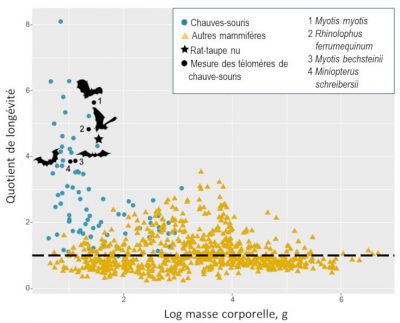
Nous avons vu précédemment que la chauve-souris parvient à modérer un stress oxydant qui entraîne généralement une inflammation chronique et une accélération du vieillissement. De même, le raccourcissement progressif des télomères (extrémités des chromosomes) normalement cause de sénescence et d’apparition de cancer, n’a pas été observé chez les chauves-souris [20]. Elles font ainsi preuve d’une longévité exceptionnelle (Figure 11) avec peu de signes de sénescence et un taux négligeable de cancers. Sur 19 espèces de mammifères qui vivent proportionnellement plus longtemps que les êtres humains en tenant compte de leur taille corporelle, 18 sont des chauves-souris, avec un record détenu par un Murin de Brandt (Myotis brandtii) qui, pour un poids de 7 g, a dépassé l’âge de 41 ans. Cette longévité est propice à la persistance des virus chez les individus et aux échanges viraux sur le long terme entre les générations de juvéniles et les adultes.
3.6. Léthargie et torpeur

La léthargie est une stratégie employée par les chauves-souris des pays tempérés pour survivre à la pénurie d’insectes qui survient durant les saisons froides tandis que d’autres animaux comme les oiseaux choisissent de migrer vers des contrées plus clémentes.

3.7. Importance de la vie en commun
D’individuelle, la persistance virale peut également s’exprimer à l’échelle collective. Les Chiroptères ont une forte propension à se regrouper en colonies de centaines, voire de milliers d’individus d’âges éloignés et parfois d’espèces différentes. La plus grande concentration connue de mammifères se situe dans la grotte de Braken Cave au Texas qui concentre plus de 20 millions de Molosses du Brésil (Tadarida brasiliensis mexicana) (Figure 14). Il faut au moins 3 h pour que toute la colonie sorte de la cavité !

Dans ces regroupements, il a bien été montré que la nature et la taille des colonies jouent un rôle important dans la maintenance virale et l’apparition de nouveaux variants. On pense que les échanges viraux entre adultes et juvéniles favorisent la chronicité des infections alors qu’entre individus d’espèces différentes, c’est la diversité virale qui s’accroît. Les chercheurs en viennent à se demander si cette habitude de vivre en sympatrie ne serait pas le facteur déterminant qui a amené les chauves-souris à tolérer les virus tout en développant des capacités immunitaires uniques dont on commence depuis peu à en cerner les aspects.
3.8. Des capacités immunitaires uniques
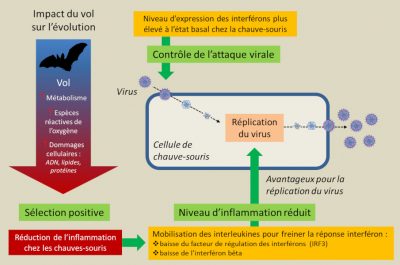
En fait, les chauves-souris semblent capables de restreindre leur réaction immunitaire vis-à-vis d’agents pathogènes avec lesquels elles partagent une longue histoire évolutive de manière à limiter les conséquences immunopathologiques d’une infection [22]. Une sorte de pacte de non-agression semble s’être établi entre elles et les virus.
L’analyse récente de six génomes de chauves-souris [13] a montré une grande variété de virus endogènes, ce qui tend à conforter cet état de tolérance vis-à-vis de virus reconnus ainsi comme des éléments du soi de la chauve-souris. Elle a également révélé la concentration de la réponse inflammatoire sur un nombre restreint de gènes et l’existence de nouveaux gènes impliqués dans la tolérance aux infections virales. Cette étude envisage de mieux comprendre comment les chauves-souris tolèrent les infections à coronavirus.
La reconnaissance du rôle des chauves-souris dans les épidémies virales présente le risque de les en rendre responsables et donc d’envisager leur éradication comme solution au risque infectieux. Cette réaction malheureusement intuitive, s’avèrerait totalement inappropriée et même préjudiciable pour la santé humaine. Elle a déjà été testée en Ouganda où dans le cadre de campagnes de prévention des infections à virus Marburg, des destructions de roussettes ont été réalisées dans certaines mines. Il en a résulté une ré-invasion de ces sites par des chauves-souris sensibles et des réintroductions multiples du virus dans de nouvelles populations connectées entre elles.
Réagir comme cela, c’est oublier que les Chiroptères sont des espèces clés dans le fonctionnement des écosystèmes. En milieu tropical, elles jouent un rôle significatif dans la pollinisation des plantes et la dissémination à distance des graines. Les êtres humains en tirent profit en les consommant et en exploitant leur guano comme fertilisant. Quant aux chauves-souris insectivores, elles exercent un rôle majeur dans la régulation des populations d’insectes et participent de ce fait à une réduction de l’usage des pesticides. Très sensibles aux changements de leur environnement, les chauves-souris s’avèrent être d’excellents indicateurs de la santé de notre environnement.
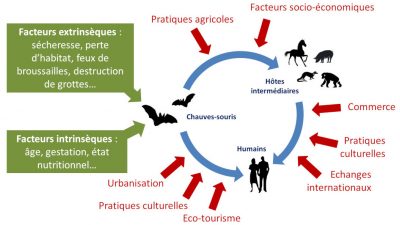
D’une manière plus globale, il faudra agir sur les facteurs de risque qui exposent les êtres humains à la faune sauvage et aux chauves-souris. La pandémie de COVID-19 est là pour nous le rappeler. En effet, elle a rendu évident que la maîtrise de ces risques passe par une collaboration étroite entre les domaines de la santé humaine, de la santé animale et de la santé des écosystèmes. Autrement dit : médecins, pharmaciens, vétérinaires et écologues mais aussi économistes et juristes doivent travailler ensemble à promouvoir une écologie de la santé, approche essentielle pour parer aux futures épidémies et éviter qu’elles ne se transforment en crises sanitaires (Lire Les pandémies de l’ère moderne).
5. Messages à retenir
- Les chauves-souris sont les hôtes naturels de nombreux virus émergents sans qu’elles ne soient pour autant affectées par la plupart d’entre eux.
- Les chauves-souris sont les hôtes privilégiés des virus de par leur diversité d’espèces, 2e ordre chez les Mammifères, de régimes alimentaires et de niches écologiques.
- Des recherches sont menées sur le virome (ensemble des génomes viraux) des chauves-souris qui démontrent qu’elles ne sont pas directement responsables des maladies virales humaines.
- Leur apparition remonte à plus de 65 millions d’années ce qui leur a laissé le temps de coévoluer étroitement avec les virus.
- De singulières adaptations ont fait le succès des Chiroptères : capacités de vol et d’écholocation, longévité exceptionnelle, aptitude à entrer dans des états de léthargie ou de torpeur, instinct grégaire et système immunitaire unique qui ont contribué à leur large tolérance aux infections
- Les Chiroptères sont des espèces clés dans le fonctionnement des écosystèmes et d’excellents indicateurs de santé de notre environnement.
- Les causes des épidémies sont plutôt à rechercher dans le bouleversement des écosystèmes naturels dû aux activités humaines non contrôlées.
- Pour parer à de nouvelles épidémies, il faut impérativement agir sur les facteurs de risque qui exposent êtres humains et faune sauvage.
Remerciements à François Moutou pour la relecture de l’article et ses clichés exotiques ainsi qu’à Marc Pihet et Louis-Marie Préau (www.louismariepreau.com) pour leurs contributions photographiques illustrant cet article.
Notes et références
Image de couverture. Grand Murin (Myotis myotis) en vol. [Source : © Louis-Marie Préau, www.louismariepreau.com]
[1] Zhou P, Yang XL, Wang XG, Hu B, Zhang L, Zhang W, Si HR, Zhu Y, Li B, Huang CL, Chen HD, Chen J, Luo Y, Guo H, Jiang RD, Liu MQ, Chen Y, Shen XR, Wang X, Zheng XS, Zhao K, Chen QJ, Deng F, Liu LL, Yan B, Zhan FX, Wang YY, Xiao GF & Shi ZL. (2020). A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature, 579 (7798), 270-273. <doi: 10.1038/s41586-020-2012-7>.
[2] Xiao K, Zhai J, Feng Y, Zhou N, Zhang X, Zou J-J, Li N, Guo Y, Li X, Shen X, Zhang Z, Shu F, Huang W, Li Y, Zhang Z, Chen R-A, Wu Y-J, Peng S-M, Huang M, Xie W-J, Cai Q-H, Hou F-H, Chen W, Xiao L & Shen Y. (2020). Isolation of SARS-CoV-2-related coronavirus from Malayan pangolins. Nature, 583 (7815), 286-289. <doi: 10.1038/s41586-020-2313-x>.
[3] Calisher CH, Childs JE, Field HE, Holmes K & Schountz T. (2006). Bats: important reservoir hosts of emerging viruses. Clin. Microbiol. Rev. 19 (3), 531-545. <doi:10.1128/CMR.00017-06>.
[4] Middleton DJ, Morrissy CJ, van der Heide BM, Russell GM, Braun MA, Westbury HA, Halpin K & Daniels PW. (2007). Experimental Nipah virus infection in pteropid bats (Pteropus poliocephalus). J. Comp. Pathol., 136 (4), 266-272. <doi: 10.1016/j.jcpa.2007.03.002>.
[5] Hu D, Zhu C, Wang Y, Ai L, Yang L, Ye F, Ding C, Chen J, He B, Zhu J, Qian H, Xu W, Feng Y, Tan W & Wang C. (2017). Virome analysis for identification of novel mammalian viruses in bats from Southeast China. Sci Rep, 7 (1), 10917. <doi: 10.1038/s41598-017-11384-w>.
[6] Drexler JF, Corman VM, Müller MA, Maganga GD, Vallo P, Binger T, Gloza-Rausch F, Rasche A, Yordanov S, Seebens A, Oppong S, Adu Sarkodie Y, Pongombo C, Lukashev AN, Schmidt-Chanasit J, Stöcker A, Carneiro AJ, Erbar S, Maisner A, Fronhoffs F, Buettner R, Kalko EK, Kruppa T, Franke CR, Kallies R, Yandoko ER, Herrler G, Reusken C, Hassanin A, Krüger DH, Matthee S, Ulrich RG, Leroy EM & Drosten C. (2012). Bats host major mammalian paramyxoviruses. Nat. Commu., 3, 796. <doi: 10.1038/ncomms1796>.
[7] Sulkin SE & Allen R. (1974). Virology. Vol. 8. Basel: Melnick JL, Karger.
[8] Luis AD, Hayman DT, O’Shea TJ, Cryan PM, Gilbert AT, Pulliam JR, Mills JN, Timonin ME, Willis CK, Cunningham AA, Fooks AR, Rupprecht CE, Wood JL & Webb CT. (2013). A comparison of bats and rodents as reservoirs of zoonotic viruses: are bats special ? Proc Biol Sci. 280 (1756), 20122753. <doi: 10.1098/rspb.2012.2753>.
[9] Olival KJ, Hosseini PR, Zambrana-Torrelio C, Ross N, Bogich TL, Daszak P. (2017). Host and viral traits predict zoonotic spillover from mammals. Nature, 546 (7660), 646-650. <doi: 10.1038/nature22975>.
[10] Anthony SJ, Johnson CK, Greig DJ, Kramer S, Che X, Wells H, Hicks AL, Joly DO, Wolfe ND, Daszak P, Karesh W, Lipkin WI, Morse SS; PREDICT Consortium, Mazet JAK, Goldstein T. (2017). Global patterns in coronavirus diversity. Virus Evol. 3 (1), vex012. <doi: 10.1093/ve/vex012>.
[11] Letko M, Seifert SN, Olival KJ, Plowright RK & Munster VJ. (2020). Bat-borne virus diversity, spillover and emergence. Nat Rev Microbiol, 18 (8), 461-471. <doi: 10.1038/s41579-020-0394-z.>.
[12] Mollentze N, Streicker DG. (2020). Viral Zoonotic Risk Is Homogenous Among Taxonomic Orders of Mammalian and Avian Reservoir Hosts. Proc. Natl. Acad. Sci. USA, 117 (17), 9423-9430. <doi: 10.1073/pnas.1919176117>.
[13] Jebb D, Huang Z, Pippel M, Hughes GM, Lavrichenko K, Devanna P, Winkler S, Jermiin LS, Skirmuntt EC, Katzourakis A, Burkitt-Gray L, Ray DA, Sullivan KAM, Roscito JG, Kirilenko BG, Dávalos LM, Corthals AP, Power ML, Jones G, Ransome RD, Dechmann DKN, Locatelli AG, Puechmaille SJ, Fedrigo O, Jarvis ED, Hiller M , Vernes SC, Myers EW & Teeling EC. (2020). Six reference-quality genomes reveal evolution of bat adaptations. Nature, 583, 579-584. <doi: 10.1038/s41586-020-2486-3>.
[14] Zhang T, Wu Q, Zhang Z. (2020). Probable Pangolin Origin of SARS-CoV 2 Associated with the COVID-19 Outbreak. Curr. Biol. 30 (7), 1346-1351.e2. <doi: 10.1016/j.cub.2020.03.022>.
[15] Damas J, Hughes GM, Keough KC, Painter CA, Persky NS, Corbo M, Hiller M, Koepfli KP, Pfenning AR, Zhao H, Genereux DP, Swofford R, Pollard KS, Ryder OA, Nweeia MT, Lindblad-Toh K, Teeling EC, Karlsson EK, Lewin HA. (2020). Broad host range of SARS-CoV-2 predicted by comparative and structural analysis of ACE2 in vertebrates. Proc. Natl. Acad. Sci. U.S.A. 2020 Aug 21:202010146. <doi: 10.1073/pnas.2010146117>.
[16] O’Shea TJ, Cryan PM, Cunningham AA, Fooks AR, Hayman DTS, Luis AD, Peel AJ, Plowright RK & Wood JLN. (2014). Bat flight and zoonotic viruses. Emerg. Infect. Dis. 20 (5) : 741-745. <doi:10.3201/eid2005.130539>.
[17] Brook CE & Dobson AP. (2015). Bats as special reservoirs for emerging zoonotic pathogens. Trends Microbiol. 23 (3), 172-180. <doi: 10.1016/j.tim.2014.12.004>.
[18] Zhang G, Cowled C, Shi Z, Huang Z, Bishop-Lilly KA, Fang X, Wynne JW, Xiong Z, Baker ML, Zhao W, Tachedjian M, Zhu Y, Zhou P, Jiang X, Ng J, Yang L, Wu L Xiao J, Feng Y, Chen Y, Sun X, Zhang Y, Marsh GA, Crameri G, Broder CC, Frey KG, Wang L-F & Wang J. (2013). Comparative analysis of bat genomes provides insight into the evolution of flight and immunity. Science, 339 (6118), 456-460. <doi: 10.1126/science.1230835>.
[19] Banerjee A, Baker ML, Kulcsar K, Misra V, Plowright R & Mossman K. (2020). Novel insights into immune systems of bats. Front Immunol, 11, 26. <doi: 10.3389/fimmu.2020.00026>.
[20] Foley NM, Hughes GM, Huang Z, Clarke M, Jebb D, Whelan CV, Petit EJ, Touzalin F, Farcy O, Jones G, Ransome RD, Kacprzyk J, O’Connell MJ, Kerth G, Rebelo H, Rodrigues L, Puechmaille SJ, Teeling EC. (2018). Growing old, yet staying young: The role of telomeres in bats’ exceptional longevity. Sci. Adv. 4 (2), eaao0926. <doi: 10.1126/sciadv.aao0926>.
[21] Kacprzyk J, Hughes GM, Palsson-McDermott EM, Quinn SR, Puechmaille SJ, O’Neill LAJ & Teeling EC. (2017). A potent anti-inflammatory response in bat macrophages may be linked to extended longevity and viral tolerance. Acta Chiropter, 19 (2), 219-228. <doi: 10.3161/15081109ACC2017.19.2.001>.
[22] Mandle JN, Schneider C, Schneider DS & Baker ML. (2018). Going to bat(s) for studies of disease tolerance. Front. Immunol, 9 (2112). < doi: 10.3389/fimmu.2018.02112>.
[23] Gibb R, Redding DW, Chin KQ, Donnelly CA, Blackburn TM, Newbold T & Jones KE. (2020). Zoonotic host diversity increases in human-dominated ecosystems. Nature, 584 (7821), 398-402. <doi: 10.1038/s41586-020-2562-8>.
[24] Afelt A, Frutos R & Devaux C. (2018). Bats, Coronaviruses, and Deforestation: Toward the Emergence of Novel Infectious Diseases ? Front. Microbiol. 9, 702. <doi: 10.3389/fmicb.2018.00702>.
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : LARCHER Gérald (22 février 2022), Chauves-souris et virus ou comment cohabiter en harmonie, Encyclopédie de l’Environnement. Consulté le 27 juillet 2024 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/vivant/chauves-souris-virus-comment-cohabiter-en-harmonie/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.




