Phytoremédiation : restauration des sols pollués par les végétaux
PDF
Les activités humaines sont largement responsables des pollutions des sols et des eaux et plus généralement des atteintes globales à l’environnement. Chacun d’entre nous a déjà été confronté à des situations de très fortes pollutions ou agressions de la nature, telles que les impacts des biocides (herbicides, insecticides, fongicides…), des hydrocarbures ou des métaux et éléments inorganiques toxiques (Cu, Ni, Cd, Pb, Cr, Hg, Sn, As, Tl…). Heureusement, sur le long terme la nature est capable d’une certaine résilience en s’adaptant à certains types de pollutions, notamment grâce à l’activité des microorganismes et des végétaux. Cette capacité de la nature a depuis longtemps inspiré les hommes, notamment pour le traitement de leur eau potable (> 3000ans). Aujourd’hui, la nature inspire de nouvelles approches de remédiations intégrées de ces milieux pollués, notamment des approches bio-inspirées. Elles s’inscrivent dans le cadre d’une écologie globale, qui mobilise différents champs disciplinaires de l’écologie scientifique (végétale, microbienne, moléculaire, évolutive, fonctionnelle, chimique…), de la biologie, de la toxicologie, de la physicochimie et de la chimie du vivant. Parmi elles, la phytoremédiation (ensemble de technologies utilisant les plantes pour extraire, dégrader ou immobiliser des composés ou éléments polluants) est une des approches les plus prometteuses, même si elle est plutôt destinée à la résolution de problèmes environnementaux générés par les éléments traces métalliques, ou ETM.
1. Pourquoi faut-il remédier les sols ?
Les innombrables activités humaines affectent aujourd’hui la dynamique biologique et les équilibres biogéochimiques (Lire La biosphère, un acteur géologique majeur). Des indicateurs forts, tels que changement climatique, érosion de la biodiversité, pollution des sols, des cours d’eau et des nappes phréatiques, témoignent de la nécessité d’élaborer de nouvelles stratégies de préservation, voire de réhabilitation de la biosphère et des services écosystémiques associés. Les activités anthropiques et les déchets générés, qu’ils soient domestiques, industriels ou agricoles, contribuent largement à l’étendue des pollutions et à des atteintes à l’environnement.
1.1. Les polluants majeurs des sols
Ainsi par exemple, les biocides [1] sont des composés chimiques dotés de propriétés toxicologiques, destinés à lutter contre la propagation d’insectes ou rongeurs nuisibles, d’algues, de plantes envahissantes ou de champignons phytopathogènes. Leurs toxicité et écotoxicité sont préoccupantes. Les résidus de produits phytosanitaires, de principes pharmaceutiques, solvants, résidus plastiques, cosmétiques… et de leurs produits de dégradation constituent des polluants émergents problématiques. Leurs mauvaises utilisations entraînent leur dispersion dans l’air, leur absorption par les plantes ou leur pénétration dans les sols où ils sont ensuite entraînés vers les milieux aquatiques par les eaux de pluie, contaminant alors cours d’eau, eaux souterraines et zones littorales (Lire Pourquoi et comment traiter les eaux usées urbaines ? & Pesticides : ce que nous enseigne le passé).
1.2. Une toxicité et des effets indirects importants
D’un point de vue général, leur toxicité est due à leur similitude structurale avec les éléments essentiels, leur permettant de les substituer de façon compétitive, notamment dans les macromolécules biologiques comme les enzymes contenues dans les cellules. Ainsi, par exemple :
- Le plomb est capable de déplacer le calcium dans le tissu osseux. Il est alors stocké de façon insidieuse et discrète, puis libéré massivement lors d’une fracture, un traumatisme ou un stress.
- Dans le cas des sels de cuivre, la pollution est occasionnée par une utilisation fréquente (tuyauteries de distribution, câbles électriques, algicides, antifongiques, …) et une persistance des espèces métalliques. Nocifs pour les mammifères, ils sont aussi très toxiques pour les organismes marins [2].
Les pollutions métalliques présentent donc des risques réels pour la santé : les atteintes des systèmes nerveux, rénal, pulmonaire ou des tissus osseux sont clairement établies (Lire Le mercure, le poisson et les chercheurs d’or). De fortes teneurs en éléments traces métalliques diminuent la biodiversité, la densité et l’activité de la flore et de la faune, y compris à l’échelle la plus petite. La fertilité du sol est altérée ; les animaux sont contaminés par contact, inhalation de poussières métalliques, ingestion d’eau et d’aliments… Les polluants métalliques se propagent à travers la chaîne alimentaire.

- Les pollutions métalliques conduisent à une phytotoxicité des systèmes sols et, par la suite, à leur érosion accrue.
- L’érosion des sols entraîne une migration des éléments traces métalliques dans les systèmes sols-eau et une contamination des rivières (Figure 2) ;
- Ces phénomènes réduisent la fertilité des sols et entraînent la contamination des produits agricoles et alimentaires.
1.3. Des conséquences inquiétantes
Les effets cumulés de l’évolution climatique (sécheresses, pluies intenses mais courtes, réchauffement global) et les différentes formes de pollutions précitées, associées à une surconsommation de l’eau et des produits agro-alimentaires font craindre à court terme une raréfaction des ressources vitales. L’atteinte de la qualité des sols et des surfaces cultivables est très préoccupante (Figure 3). Elle constitue un enjeu majeur de la sécurité alimentaire mondiale, qui est soumise à des contraintes croissantes [2] :
- Un défi démographique: la population mondiale devrait atteindre 9 milliards d’habitants en 2050 avec une urbanisation accrue de cette population (2/3 de la population mondiale en 2050 contre la moitié aujourd’hui) ;
- Un changement/réchauffement climatique: avec des conséquences sur les événements extrêmes et une pression sur les rendements agricoles ;
- Une globalisation du marché mondial des denrées agricoles et alimentaires, couplée à une évolution négative des habitudes alimentaires ;
- Une pression accrue sur les ressources, en quantité comme en qualité : diminution de la disponibilité en eau potable accentuée par une répartition inégalitaire, épuisement des ressources minérales, diminution de la disponibilité en terres arables, évolution des services écosystémiques, conversion de l’usage des terres, épuisement de certaines ressources de la mer.

2. La phytoremédiation : une solution naturelle et durable
En 2002, Isenmann concevait l’écologie industrielle comme étant une discipline qui prenait la nature comme modèle [3]. Aujourd’hui, ce concept se transforme en pistes d’actions concrètes pour lesquelles il ne s’agit pas d’envisager un retour à une situation initiale. Le manque de données sur la caractérisation détaillée des interactions biotiques et abiotiques d’un écosystème particulier et antérieur à la pollution industrielle et les perturbations physicochimiques introduites par les activités anthropiques, excluent le retour d’un habitat naturel à une situation préindustrielle. Il ne s’agit donc pas de restauration écologique au sens strict de sa définition [4]. En revanche, la présence et l’étude des organismes adaptés à une situation de pollution industrielle permettent de définir de nouvelles approches de remédiation intégrées et bio-inspirées. Elles s’inscrivent dans le cadre d’une écologie globale, qui mobilise différents champs disciplinaires de l’écologie scientifique (végétale, microbienne, moléculaire, évolutive, fonctionnelle, chimique…), de la biologie, de la toxicologie, de la physicochimie et de la chimie du vivant.
Deux scenarii sont envisageables pour les sites dégradés : la stabilisation ou la remédiation active. Ces techniques de remédiation peuvent être schématiquement réparties en deux grands secteurs : la bioremédiation et la phytoremédiation.
La bioremédiation repose sur l’utilisation déjà bien connue d’espèces bactériennes spécifiques et adaptées à la décontamination de zones contaminées[5], notamment par les polluants organiques ou métalliques voire même récemment les radionucléides [6], [7].
La phytoremédiation est plutôt destinée à la résolution de problèmes environnementaux générés par les éléments traces métalliques. Compte tenu de leur phytotoxicité, les sols métallifères exercent une forte pression de sélection et génèrent des habitats particuliers pour les espèces végétales et les micro-organismes associés. Il en résulte une ressource biologique unique, les métallophytes [8]. Ces métallophytes sont définis comme étant capables de tolérer des concentrations en ETM, et donc de survivre et se reproduire sur de tels sites [9].
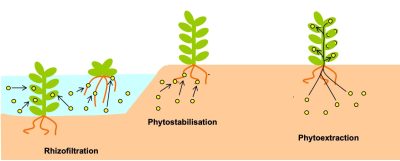
- la phytoextraction: les polluants sont extraits par les plantes et stockés dans leurs tissus (feuilles ou racines) ;
- la phytostabilisation: elle consiste à recouvrir les sols par des espèces végétales capables d’immobiliser la pollution ;
- la rhizofiltration: le procédé de phytoextraction s’effectue en milieu aquatique au niveau de la rhizosphère (partie du sol proche des racines des plantes). La phytoremédiation est une des rares solutions intéressantes de réhabilitation durable des sols dégradés ou contaminés par les ETM.
Les phytotechnologies les plus étudiées sont la phytostabilisation et la phyto-extraction [10], [11], [12], [13].
Diverses expériences antérieures ont montré que la phytostabilisation permet d’immobiliser les contaminants et contribuer à la croissance de la végétation sur des zones hostiles. En revanche, elle favorise l’apparition spontanée de végétaux qui deviennent parfois capables d’accumuler les ETM, avec un risque pour les animaux. Ainsi, l’évolution dans le temps des parcelles revégétalisées pose le délicat problème de la maîtrise des risques dans la durée.
3. Quelques retours d’expériences en restauration minière
Dans un contexte d’épuisement rapide des ressources mondiales en minéraux primaires et stratégiques, certains étant devenus critiques, les techniques de recyclage restent peu développées et le maintien d’une demande forte en éléments métalliques laisse présager un épuisement à court terme des ressources actuelles de métaux critiques. Ces besoins conduisent les opérateurs miniers à étendre leurs exploitations et à utiliser de nouvelles techniques d’extraction, au prix d’importants impacts environnementaux : dégradation de milieux naturels, perte de biodiversité, pollution des écosystèmes, etc [15],[16].
Afin de restaurer (et donc remédier) les milieux naturels dégradés ou pollués par les activités minières, des premières recherches en restauration minière ont consisté à développer des programmes de phytoremédiation innovants sur sites et à grande échelle dans les principaux pays extracteurs de métaux, et notamment la France (métropole et territoires d’Outre-Mer comme la Nouvelle-Calédonie, notamment). Les travaux de terrain ont le plus souvent été réalisés en collaboration étroite avec les opérateurs miniers des différents pays.
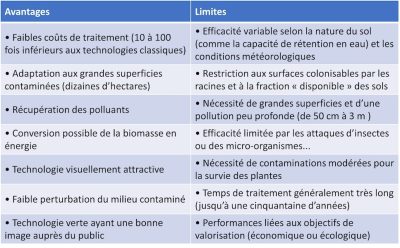
Tableau 1. Avantages et inconvénients des approches de phytoremédiation.
3.1. La phytoextraction
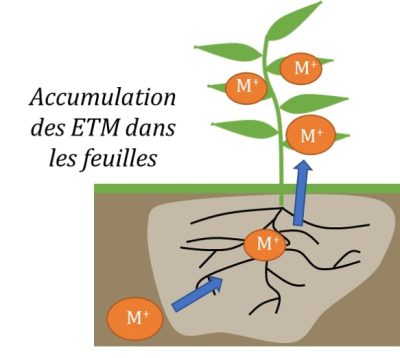
La phytoextraction a été souvent privilégiée, car elle est l’une des phytotechnologies les plus prometteuses, capable d’apporter une dimension sociale et économique aux efforts de réhabilitation. La phytoextraction repose sur l’utilisation de plantes capables d’extraire les éléments métalliques des sols et de les concentrer dans leurs parties aériennes. On parle d’espèces hyperaccumulatrices si celles-ci sont capables de contenir des taux de 100 mg Kg-1 de Cd ou As, 1000 mg kg-1 de Co, Cu, Cr, Pb ou Ni, 10 000 mg kg-1de Mn ou Zn dans la matière sèche.
Cette technologie naturelle contribue ainsi à la diminution lente et progressive de la teneur en ETM dans les sols contaminés. Elle permet surtout l’introduction d’un couvert végétal protecteur sur les sites les plus pollués ou dégradés, qui est capable de limiter l’érosion éolienne et/ou hydraulique des sites réhabilités.
Les deux exemples illustratifs présentés ci-dessous, ont été réalisés dans des contextes où les attentes des populations concernées en matière environnementale et économique sont très différentes, mais où les phénomènes d’adaptation naturelle de certains végétaux et micro-organismes associés sont communs.
3.2. Le cas de la mine des Avinières dans le Gard
Dans le Gard, le site minier des Avinières est un haut lieu de contamination (500 à 800 fois plus de Zn, Cd et Pb que dans les normes européennes). Des efforts d’écologie microbienne et végétale ont permis d’établir une première preuve de concept de réhabilitation à grande échelle à l’aide de la phytoextraction à l’aide de forts hyperaccumulateurs de Zn présents sur le site, Noccaea caerulescens et Anthyllis vulneraria (Figure 6) [17], [18].
Anthyllis vulneraria est une espèce végétale étonnante. Elle est une des rares légumineuses capables de croître sur des terres hautement polluées. A. vulneraria a été identifiée sur le site minier des Avinières (Gard).
La caractérisation phénotypique, génotypique et métabolique de la nouvelle espèce bactérienne (Rhizobium metallidurans) associée à la légumineuse hyperaccumulatrice de Zn, Anthyllis vulneraria, a permis de comprendre les stratégies d’adaptation de cette bactérie hors-norme au niveau génétique mais aussi physiologique et moléculaire [19], [20], [21].
Le degré de pollution local est théoriquement incompatible avec toute forme de vie. Pourtant, A. vulneraria est capable de survivre dans ce milieu toxique. Plus étonnant encore, elle accumule le zinc à des concentrations impressionnantes et inégalées. Il s’agit d’un des plus forts hyperaccumulateurs de zinc, identifiés à ce jour.

- vulneraria est devenue une opportunité pour l’extraction du Zn, grâce à sa forte capacité à l’accumuler, mais aussi pour ses aptitudes agronomiques, sa biomasse abondante, et son système racinaire important et capable d’augmenter la matière organique azotée du sol contaminé et donc sa fertilité, comme toute légumineuse. Elle a permis le développement d’un second hyperaccumulateur de zinc (N. caerulescens) sur le site minier qui était totalement dévégétalisé. Aujourd’hui, la nature reprend lentement ses droits et d’autres espèces végétales plus communes se sont installées, même si on estime qu’il faudrait encore quelques décennies pour revenir à un état écologique initial.
3.3. Le cas des mines à ciel ouvert de Nouvelle Calédonie
La réussite de ce programme a conduit à poursuivre les efforts de restauration minière in natura en Nouvelle-Calédonie (Figure 3).
– La Nouvelle-Calédonie, haut-lieu de la biodiversité mondiale, héberge 3 260 espèces végétales avec un taux d’endémisme d’environ 74 %. La diversité floristique de Nouvelle-Calédonie est étroitement liée à son histoire géologique. Celle-ci a entrainé des conditions édaphiques (le sol) très particulières : une grande partie du sol du territoire est riche en éléments phytotoxiques : Ni, Co, Cr, Mn, Fe. Ces conditions géochimiques très particulières ont généré l’émergence d’une flore originale composée de plantes qui se sont adaptées aux sols ultramafiques* (glossaire : une roche ultramafique ou roche ultrabasique est une roche magmatique et méta-magmatique riche en métaux (fer, magnésium, etc.) et très pauvre en silice (moins de 45 % en masse), d’où leur caractère basique).

Ce contexte est exceptionnel, et représente un exemple d’adaptation remarquable du monde végétal.
Cependant, ces conditions géochimiques sont également à l’origine d’extractions minières intenses, qui menacent parallèlement cette même biodiversité. À ce jour, on recense plus de 23 000 ha impactés par des activités minières entrainant une forte érosion des sols, qui pollue le lagon et menace le récif corallien. Depuis 2009, la règlementation a rendu la réhabilitation obligatoire (Figure 8), mais seuls 371 ha ont été revégétalisés car de nombreuses connaissances scientifiques restent à acquérir, preuve de la difficulté de la mise en œuvre de ces approches nouvelles mais complexes.
Dans ce contexte, une nouvelle approche de la restauration minière a été développée [13].

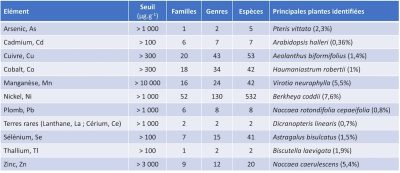
La réussite de ces travaux, allie expériences de terrain à grande échelle (>6 ha) et recherche fondamentale [11], [23]. Il est, en effet, encore nécessaire de progresser dans la connaissance des capacités adaptatives des plantes métallophytes sur sites miniers dégradés. Les objectifs de remédiation des sites dégradés et/ou contaminés par les activités minières doivent clairement être déployées sur le long terme. L’état des sites, la planification raisonnée et durable des opérations, la croissance des plants sur des sols meurtris, le respect de la biodiversité locale, le suivi des transplantations, la vitesse d’accumulation en témoignent. Dans un tel contexte, il est évident qu’une valorisation économique de la remédiationest indispensable pour soutenir de tels efforts dans la durée. Il s’agit « d’un gage de durabilité » et donc de réussite. Une base de données existe, recensant les associations métaux – espèces hyperaccumlulatrices connues à ce jour [24] et dont certains exemples sont donnés dans le Tableau 2 suivant.
Tableau 2. Quelques exemples d’association des polluants avec des plantes hyperaccumulatrices (en septembre 2017) pour la phytoextraction avec enregistrements mondiaux des plus fortes concentrations rapportées à ce jour.
4. Une valorisation nécessaire de la phytoextraction
Le développement de la phytoextraction reste limité surtout par l’absence de valorisation de la biomasse contaminée. Sans débouché crédible, les parties aériennes des plantes hyperaccumulatrices sont considérées comme des déchets contaminés. De plus, le phénomène d’extraction des éléments traces métalliques par le système racinaire augmente la fraction des éléments solubles. L’essor de la phytoextraction est entièrement lié à la valorisation de la biomasse générée.
Les deux stratégies les plus significatives de recyclage des plantes hyper-accumulatrices d’éléments traces métalliques reposent sur deux filières classiques et indépendantes :
- la filière inspirée du traitement de la biomasse: Bioénergie, et plus particulièrement la filière bois-énergie [25], [26];
- la filière inspirée du traitement du minerai: l’hydrométallurgie adaptée aux métaux d’origine végétale ou phytoextraction minière (phytomining [27], [28], [29], [30], [31]).
Dans le cas de la filière bois-énergie, deux problèmes immédiats encore non résolus concernent le devenir des résidus de combustion (et de leur toxicité éventuelle), ainsi que la volatilité des espèces métalliques lors de la combustion [16],[17]. Beaucoup de questions restent donc en suspens.

L’écocatalyse a créé un changement de paradigme : la biomasse gorgée de métaux de transition n’est plus un déchet contaminé, mais un système naturel de restauration qui possède une haute valeur ajoutée. Cette biomasse constitue donc un réservoir naturel de métaux de transition précieux en synthèse organique. En d’autres termes, des déchets sont devenus des objets chimiques utiles, innovants et valorisables.
5. Messages à retenir
- Il est possible de développer la phytoextraction comme technique de restauration minière de sols dégradés/contaminés en s’appuyant sur des espèces végétales locales et adaptées au contexte de forte contamination et de dégradation des zones à réhabiliter.
- La phytoextraction des contaminants est une démarche nouvelle et prometteuse ; elle permet de conjuguer l’introduction d’espèces pionnières et durables compatibles avec les objectifs de valorisation.
- La restauration de sites miniers impactés par la pollution métallique et la valorisation chimique des phytotechnologies développées par écocatalyse permettent de concilier écologie, technologie et économie.
- Les activités économiques ne se traduisent pas en coûts environnementaux, mais en bénéfices, permettant de soutenir les efforts de remédiation des sites pollués.
Notes et références
Image de couverture. La Nouvelle-Calédonie, haut lieu de l’activité minière, est un territoire pionnier en phyto-remédiation [Source © C. Grison]
[1] https://www.anses.fr/fr/content/l%C3%A9valuation-des-produits-biocides-comment-%C3%A7a-marche
[2] Allenvi GT7. http://www.allenvi.fr/, 2 septembre 2015
[3] Diemer A., Labrune S., L’écologie industrielle : quand l’écosystème industriel devient un vecteur du développement durable, disponible à l’adresse : http://developpementdurable.revues.org/4121, 2 septembre 2015.
[4] Clewell A.F. and James Aronson, Ecological restoration, principles, values, and Structure of an Emerging Profession by IslandPress, 2nd Ed. 2013.
[5] https://www.ademe.fr/sites/default/files/assets/documents/43479_etude_adit_sols.pdf.
[6] Samakshi Verma, Arindam Kuila, Bioremediation of heavy metals by microbial process, Environ. Technol. & Innov. Volume 14, 2019,100369.
[7] Sharma B., A.K. Dangi, P. Shukla. Contemporary enzyme-based technologies for bioremediation: A review,
Journal of Environ. Management, Volume 210. 2018, 10-22.
[8] Baker A.J., Ernst W.H., Van der Ent A. et al., « Metallophytes: the unique biological resource, its ecology and conservational status in Europe, central Africa and Latin America ». Ecology of Industrial Pollution, Cambridge University Press, Cambridge, pp. 7-40, 2010.
[9] Van der Ent A., Baker A.J.M., Reeves R.D. et al., « Hyperaccumulators of metal and metalloid trace elements: facts and fiction », Plant Soil, vol. 362, pp. 319-334, 2013.
[10] Mench M., Lepp N., Bert V. et al., « Successes and limitations of phytotechnologies at field scale : outcomes, assessment and outlook from COST Action 859 », J. Soil. Sediment., vol. 10, pp. 1039-1070, 2010.
[11] Mench M., Schwitzguebel J.P., Schroeder P. et al., « Assessment of successful experiments and limitations of phytotechnologies : contaminant uptake, detoxification and sequestration, and consequences for food safety », Environ. Sci. Pollut. Res., vol. 16, pp. 876-900, 2009.
[12] Vangronsveld J., Herzig R., Weyens N. et al., « Phytoremediation of contaminated soils and groundwater : lessons from the field », Environ. Sci. Pollut. Res., vol. 16, p. 765-794, 2009.
[13] Bert V., Seuntjens P., Dejonghe W. et al., « Phytoremediation as a management option for contaminated sediments in tidal marshes, flood control areas and dredged sediment landfill sites », Environ. Sci. Pollut. Res., vol. 16, pp. 745-764, 2009.
[14] Grison C.M., Mazel M., Sellini A. Escande V., Biton J., Grison C. The leguminous species Anthyllis vulneraria as a Zn-hyperaccumulator and eco-Zn catalyst resources, Environ. Sci. Pollut. Res., 2015, 22, pp. 5667-5676.
[15] Reeves, R.D.; Baker, A.J.M. In Phytoremediation of Toxic Metals, Using Plants to Clean Up the Environment; Raskin, I., Ensley, B.D., Eds.; John Wiley: London, 2000, 232 233.
[16] Grison, C. Combining phytoextraction and ecocatalysis: a novel concept for greener chemistry, an opportunity for remediation. Environ. Sci. Pollut. Res. 2015, 22:5589-5591 et références citées.
[17] Grison C., Escande V., Biton J., Ecocatalysis: A New Integrated Approach to Scientific Ecology. ISTE Press Ltd, ELSEVIER Ltd 2015.
[18] Grison C., Combining Phytoextraction and EcoCatalysis: an Environmental, Ecological, Ethic and Economic Opportunity, Environ. Sci. Pollut. Res. 2015,22, pp 5589-5698.
[19] Grison C. M., Petit E., Dobson A., Grison C., Rhizobium metallidurans sp. nov., a symbiotic heavy-metal resistant bacterium isolated from the Anthyllis vulneraria Zn-hyperaccumulator, Int.J. Syst. Evol. Microbiology., 2015, vol. 65, pp. 1525-1530.
[20] Vidal C., Chantreuil C., Berge O. et al., « Mesorhizobium metallidurans sp nov., a metal-resistant symbiont of Anthyllis vulneraria growing on metallicolous soil in Languedoc, France », Int. J. Syst. Evol. Micr., 2009, vol. 59, pp. 850-855.
[21] Grison C. M., Renard B.L., Grison C., A simple synthesis of 2-keto-3-deoxy-D-erythro-hexosonic acid isopropyl ester, a key sugar for the bacterial population living under metallic stress, Bioorganic Chemistry, 2014, 52C, pp. 50-55.
[22] L’Huillier L., Jaffre T., Wulff A. Mines et environnement en Nouvelle-Calédonie: les milieux sur substrats ultramafiques et leur restauration., Editions IAC, 2010.
[23] Garel C., Fonda E., Michalowicz A., Diliberto S., Boulanger C., Petit E., Legrand Y.M., Poullain C., Grison C. Structure and composition of the first biosourced Mn-rich catalysts with a unique vegetal footprint, Mat. Tod. Sust. 2019, 5, pp 100020.
[24] Reeves R.D., A.J.M. Baker, T. Jaffrée, P.D. Erskine, G. Echevarria and A. van der Ent. A global database for plants that hyperaccumulate metal and metalloid trace elements. New Phytologist (2017) 218: 407–411.
[25] Bert V., Tack K., Vialletelle F. et al., « Prospects in biomass valorization from phytoextraction of Cd, Pb and Zn with hyperaccumulators », Recents Progrès en Génie des Procédés, vol. 98, p. 297, 2009.
[26] Delplanque M., Collet S., Del Gratta F. et al., « Combustion of Salix used for phytoextraction: the fate of metals and viability of the processes », Biomass & Bioenergy, vol. 49, p. 160-170, 2013.
[27] Chaney R.L., Angle J.S., Baker A.J.M. et al., Method for phytomining of nickel, cobalt and other metals from soils, US Patent 5711784, 1998.
[28] Li Y.M., Chaney R., Brewer E. et al., « Development of a technology for commercial phytoextraction of nickel: economic and technical considerations », Plant Soil, vol. 249, p. 107-115, 2003.
[29] Chaney R.L., Angel J.S., Mcintosh M.S. et al., « Using hyperacumulator plants to phytoextract soil Ni and Cd », Z Naturforsch C, vol. 60, p. 190-198, 2005.
[30] Chaney R.L., Li Y.M., Angle J.S. et al., Phytoremediation of Toxic Elemental and Organic Pollutants, CRC Press, Boca Raton, 2000.
[31] Baker A. J.M., Echevarria G., Simmonot M.O., Morel J.L., Agromining: Farming for Metals, Extracting Unconventional Resources Using Plants. Springer International Publishing, 2018.
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : GRISON Claude (4 novembre 2022), Phytoremédiation : restauration des sols pollués par les végétaux, Encyclopédie de l’Environnement. Consulté le 16 mai 2024 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/sol/restauration-sols-pollues-par-vegetaux-phytoremediation/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.