Synthèse d’ATP
PDFL’ATP joue un rôle central dans le métabolisme cellulaire.[1] C’est le donneur d’énergie libre le plus important quel que soit le système biologique. Chez les eucaryotes, sa synthèse se déroule dans les mitochondries -lors de la respiration- et dans les chloroplastes -lors de la photosynthèse. C’est ce dernier exemple qui est pris ici.
Au sein de la membrane des thylacoïdes (lire Lumière sur la photosynthèse), la lumière induit le transfert d’électrons de l’eau vers le NADP+ à travers les photosystèmes II et I et le complexe cytochrome b6f, et grâce à diverses molécules mobiles : plastoquinones, plastocyanine et ferrédoxine (Figure 1) [2]. C’est la circulation des électrons le long de cette chaîne membranaire qui génère un gradient de concentration de protons, et donc un gradient électrochimique, à travers la membrane des thylacoïdes, gradient utilisé par l’ATP synthase pour la phosphorylation de l’ADP en ATP. [3]
1. Établissement d’un gradient de pH transmembranaire
1.1. Protons et transfert linéaire d’électrons
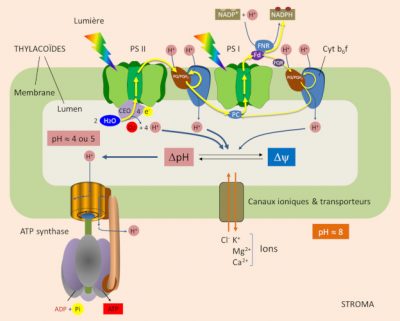
Oxydation de l’eau. L’arrivée d’un photon au niveau du P680 du PSII induit une séparation de charge qui initie le transfert des électrons vers le PSI et le NADP+. P680 passe alors dans un état oxydé porteur d’une charge positive (P680+). Pour que le système fonctionne, il est indispensable que P680+ récupère chaque électron donné. Il le fait en oxydant l’eau, selon la réaction suivante (Figure 1) :
2 H2O (eau) → O2 (oxygène) +4 H+ (protons) + 4 e– (électrons)
La production d’oxygène est ainsi accompagnée de la libération de protons dans le lumen : un proton pour chaque électron libéré par l’oxydation de H2O.
Du PSII au PSI. Le PS II transmet des électrons à la plastoquinone (PQ) au niveau de la face stromatique de la membrane des thylacoïdes. En recevant deux électrons, PQ absorbe deux protons du stroma et donne PQH2. Les deux formes PQ/PQH2 sont mobiles au sein de la membrane et participent au cycle Q.
PQH2 diffuse vers le complexe cytochrome b6f et lui transmet deux électrons (Figure 1) :
- L’un d’entre eux va permettre de réduire le P700 du PSI via la plastocyanine ;
- L’autre électron va permettre de régénérer PQH2 (ce qui boucle le cycle Q).
Au cours de ce processus, le complexe cytochrome b6f pompe, à travers la membrane des thylacoïdes, des protons du stroma qui s’accumulent dans le lumen.
Bilan. Au total, pour chaque électron transféré de H2O au côté réducteur de PS I, trois protons s’accumulent dans le lumen :
- un proton pour chaque électron libéré par l’oxydation de H2O par le PS II (§ 1.1) ;
- deux protons pour chaque électron transféré par la chaîne à potentiel élevé du complexe cytochrome b6f vers PS I (§ 1.2).
1.2. Protons et transfert cyclique d’électrons
Dans certains cas, la ferrédoxine ne transfère pas les électrons à la NADP+-oxydoréductase, mais va les transmettre à la plastoquinone par l’intermédiaire d’un cytochrome ; d’où le nom de transfert cyclique. Les électrons vont alors suivre la chaîne de transporteurs (PQ/PQH2, complexe Cytochrome b6f, plastocyanine) qui va réduire le P700 du PSI. De la même manière que lors du transfert linéaire d’électrons, le complexe Cytochrome b6f agit comme une pompe à protons entre le stroma et le lumen.
Le transfert cyclique d’électrons participe ainsi à l’établissement d’un gradient de proton essentiel à la synthèse d’ATP sans production nette de NADPH.
1.3. Réactions consommatrices de protons dans le stroma
Lors de la dernière étape du transfert linéaire d’électrons, ces derniers sont transférés vers le NADP+ grâce à la Ferrédoxine:NADP+ oxydoréductase (ou FNR) localisée dans le stroma. Cette réaction consomme des protons du stroma et participe donc à l’établissement d’un gradient transmembranaire :
2 ferrédoxines réduites + NADP+ (forme oxydée du Nicotinamide adénine dinucléotide phosphate) + H+ (proton) → 2 ferrédoxines oxydées + NADPH (forme réduite du Nicotinamide adénine dinucléotide phosphate)
2. Du gradient de protons au gradient électrochimique
En 1961, Peter Mitchell [4] a proposé un mécanisme pour le couplage du transfert d’électrons à la synthèse d’ATP. Il a suggéré que le flux d’électrons à travers la chaîne de transfert d’électrons entraîne l’établissement d’un gradient de protons à travers la membrane. La synthèse de l’ATP est entraînée par un flux inverse de protons le long du gradient. La proposition de Mitchell a été appelée » théorie chimioosmotique « . Elle lui a valu le Prix Nobel en 1978.
Ce gradient entre le stroma et le lumen peut être maintenu car la membrane des thylakoïdes est globalement imperméable aux protons. L’énergie inhérente au gradient de protons, appelée « force proton motrice » (Δp, exprimé en volts), pilote la synthèse d’ATP par l’ATP synthase. Elle est formée de deux composantes :
- ΔpH, qui est le gradient de concentration des protons ;
- Δψ, qui est la différence de charge (i.e. le potentiel de membrane) à travers la membrane des thylacoïdes.
Δp = ΔΨ + Z x ΔpH
Lors du transfert d’électrons, le pH du lumen devient acide (pH » 4 ou 5). Le gradient de proton transmembranaire (ΔpH) induit par la lumière est d’environ 3,5 unités de pH (voir Figure 1). Un gradient de pH de 3,5 unités à travers la membrane des thylakoïdes correspond à une force proton motrice de 0,20 V.
ΔΨ et ΔpH sont thermodynamiquement équivalents pour la synthèse de l’ATP. Mais dans les chloroplastes illuminés, le potentiel de membrane est pratiquement nul [5], car le transfert de protons dans le lumen s’accompagne d’un transfert d’ions (Cl– dans le même sens que les protons ou de Ca2+ ou de Mg2+ dans le sens inverse). Par conséquent, la neutralité électrique est maintenue et aucun potentiel de membrane n’est généré : dans les chloroplastes, la quasi-totalité de la force proton motrice provient donc du gradient de pH. D’ailleurs, l’hypothèse de Mitchell a été confirmée par la découverte d’André Jagendorf qu’une différence de pH à travers la membrane thylacoïde du chloroplaste entraîne une synthèse d’ATP. [6]
3. L’ATP synthase : une nanomachine
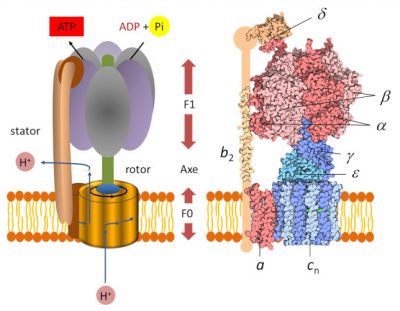
- Un domaine dit « F0 » hydrophobe, enchâssé dans la membrane des thylacoïdes. C’est un moteur électrique qui participe à la translocation des protons du lumen vers le stroma. Le flux des protons dans le moteur fait tourner un rotor* circulaire ;
- Une tête globulaire dite « F1 » soluble au sein du stroma. C’est un moteur chimique, alimenté par l’ADP.
Une tige périphérique maintient F1 ancré au stator et empêche la rotation de F1. Les deux parties F0 et F1 sont reliées l’une à l’autre par un axe fonctionnant comme un arbre rotatif. La rotation de cet arbre entraîne des changements séquentiels de conformation des sites catalytiques de F1 qui favorisent la liaison ADP et Pi, la formation d’ATP et la libération d’ATP (voir animation gif ci-dessous) selon la réaction suivante :
ADP3- (adénosine diphosphate) + H+ (proton) + HPO42- (phosphate) → ATP4- (adénosine triphosphate) + H2O (eau) (équation 2)
L’ATP synthase est donc une machine moléculaire unique dont l’architecture globale ressemble donc à celle d’un moulin à eau, entraîné par le flux de protons plutôt que par l’eau, comme le montre la vidéo suivante (en anglais, par Harward X) expliquant le fonctionnement de l’ATP synthase dans la membrane interne des mitochondries [9] :
Contrairement à l’ATP synthétisé dans la mitochondrie qui va alimenter l’ensemble des réactions cellulaires, l’ATP formé dans le stroma va servir exclusivement aux réactions qui se déroulent (synthèse de molécules carbonées, par exemple) au sein même du chloroplaste.
Il est remarquable de constater que ces recherches ont fait l’objet de 3 Prix Nobel de Chimie, attribués à Mitchell en 1978, puis à Boyer et Walker en 1997.
Notes et références
Image de couverture. Structure de l’ATP synthase, par David Goodsell (2005) Molecule of the Month, doi:10.2210/rcsb_pdb/mom_2005_12 [Image sous licence CC-BY-4.0]
[1] https://planet-vie.ens.fr/thematiques/cellules-et-molecules/les-roles-de-l-atp
[2] Avenson T.J., Kanazawa A., Cruz J.A., Takizawa K., Ettinger W.E. & Kramer D.M. (2005) Integrating the proton circuit into photosynthesis: progress and challenges. Plant, Cell and Environment 28, 97–109
[3] La membrane interne des mitochondries renferme aussi une chaine de transport d’électrons qui va permettre l’établissement d’un gradient de protons. Voir la vidéo « Electron transport chain » par le Pr. Rob Lue (HarwardX) dans le texte.
[4] Peter Dennis Mitchell (1920-1992) est un chimiste anglais. Il a reçu le prix Nobel de chimie de 1978 « pour sa contribution à la compréhension du transfert d’énergie biologique par la formulation de la théorie chimiosmotique ». La théorie de Mitchell a révolutionné notre compréhension de la bioénergétique cellulaire.
[5] Ce n’est pas le cas dans les mitochondries où la contribution du potentiel membranaire est plus importante
[6] Jagendorf A.T. & Uribe E. (1966). ATP formation caused by acid-base transition of spinach chloroplasts. Proc. Natl. Acad. Sci. USA. 55 (1): 170–177. Bibcode:1966PNAS…55..170J. doi:10.1073/pnas.55.1.170. PMC 285771. PMID 5220864.
[7] Boyer P.D. (2002) A Research Journey with ATP Synthase J. Biol. Chem. 277:39045-39061. Paul Delos Boyer (1918-2018), biochimiste américain est colauréat, avec Sir John Ernest Walker, chimiste et biologiste moléculaire britannique, du prix Nobel de chimie de 1997 pour « l’élucidation du mécanisme enzymatique sous-tendant la synthèse de l’adénosine triphosphate (ATP) ».
[8] Cette protéine appartient à une large famille constituée des complexes (a) de type F que l’on trouve dans les mitochondries (siège de la respiration), les chloroplastes (qui effectuent la photosynthèse) et les bactéries ; (b) de type V (vacuolaire) -que l’on trouve dans les compartiments intracellulaires des eucaryotes- et –c) de type A (Archéen), que l’on trouve chez les Archaea et certaines bactéries.
[9] ATP synthase in action, par le Pr. Rob Lue (HarwardX)
En savoir plus
- Une animation du transfert de protons peut être visualisée sur le site du « SUN Chloroplast E-book »
- Une animation de la synthèse d’ATP peut être visualisée sur le site du « SUN Chloroplast E-book »
- https://www.nature.com/scitable/topicpage/why-are-cells-powered-by-proton-gradients-14373960/
- https://www.ncbi.nlm.nih.gov/books/NBK22519/
- https://www.ncbi.nlm.nih.gov/books/NBK22352/#A2498
- David Goodsell (2005) Structure of ATP synthase par, Molecule of the Month, doi:10.2210/rcsb_pdb/mom_2005_12
- http://wwwa.unine.ch/bota/bioch/cours/ATPsynthase.html
- http://www.ipubli.inserm.fr/bitstream/handle/10608/594/MS_1997_12_1525.pdf?sequence=2&isAllowed=y
- https://www.nobelprize.org/uploads/2018/06/mitchell-lecture.pdf
- https://planet-vie.ens.fr/thematiques/cellules-et-molecules/les-roles-de-l-atp





