Les huîtres : ces architectes méconnus des milieux côtiers
PDF
Les huîtres sont des invertébrés marins essentiels dans nos écosystèmes côtiers. Ces architectes de l’environnement rendent de nombreux services écosystémiques tout en soutenant une activité économique florissante et structurante des paysages littoraux. Depuis plusieurs millions d’années, ils sont à l’origine de l’édification d’épaisses couches de roches sédimentaires essentielles à l’équilibre planétaire et démonstratives de leurs formidables capacités biogéniques. Mais avec l’Anthropocène, ces colosses géologiques affrontent sans répit : surexploitation, destruction d’habitat, introduction de maladies, réchauffement climatique et pollutions de tous types. Un peu comme l’abeille en milieu terrestre, mais en moins photogénique, cette espèce ingénieur est vraiment une clé de voûte du milieu marin, mais elle est menacée et il conviendrait d’y prêter plus d’attention. « Tel est pris qui croyait prendre », dans sa fable sur le rat et l’huître, La Fontaine avait déjà vu juste : nous pourrions bien devenir la victime ultime de ce déclin effréné de biodiversité.
1. L’huître : cet invertébré marin essentiel et menacé
Il existe deux espèces d’huîtres en France : l’huître plate, Ostrea edulis, [1] native de nos côtes européennes et l’huître creuse, Crassostrea gigas, introduite il y a 50 ans pour sauver l’ostréiculture française (lire Focus Une leçon d’histoire). Même si leur origine, leur histoire, leur écologie et leurs mœurs sont différentes, ces deux espèces partagent des destins communs : leur rôle essentiel dans l’équilibre de l’écosystème et la même fragilité face aux pressions anthropiques (Lire L’huître, cette sentinelle témoin d’un littoral à préserver).
1.1. Deux espèces d’huîtres, deux modèles biologiques différents

Une reproduction originale. Comme la plupart des mollusques bivalves, les huîtres présentent un cycle de vie bentho-pélagique comportant :
- une phase larvaire libre dans la colonne d’eau (on parle de forme pélagique) d’une durée de quelques semaines ;
- une phase benthique sessile (fixée sur le fond) le reste de leur vie.
Elles sont hermaphrodites, soit de façon alternative au cours de leur existence pour l’huître creuse, soit de façon consécutive à chaque saison de reproduction pour l’huître plate. En revanche, elles démarrent toujours leur première reproduction par une phase mâle, on parle alors de protandrie.
Les huîtres creuses sont dites ovipares car elles libèrent leurs gamètes dans l’eau où se fait ensuite la fécondation, alors que les huîtres plates sont vivipares !
En été, les mâles d’O. edulis libèrent des spermatozoïdes, regroupés en boule [2]. Cela leur confère un avantage sélectif car il évite une trop rapide dispersion des gamètes. Ils sont ensuite filtrés par les femelles avoisinantes : la fécondation des ovocytes se fait dans leur cavité palléale et les larves s’y développent pendant une dizaine de jours à l’abri. L’huître plate est une espèce dite incubatrice ; caractéristique très rare chez les mollusques, qui constitue un second avantage évolutif. Pendant cette période d’incubation, la progéniture grandit et l’huître mère passe du stade “laiteux” lorsque les larves sont juste formées à “ardoisé” lorsque les larves ont acquis leur première coquille et qu‘elles sont alors prêtes à être libérées dans la nature, au gré des courants [3].
Sous les latitudes françaises, l’essaimage des larves d’huîtres plates débute généralement en juin sur la côte atlantique. Cet évènement phénologique saisonnier est d’ailleurs bien connu des ostréiculteurs bretons : « quand les châtaigniers sont en fleurs, ostréiculteur pose tes collecteurs« . L’huître creuse est un peu plus exigeante sur le plan thermique, et sa ponte sur la côte atlantique n’intervient pas avant la mi-juillet. En schématisant, on pourrait dire : la Saint-Jean pour l’huître plate et le 14 juillet pour l’huître creuse ! Mais les conditions climatiques de l’année en cours peuvent avancer ou retarder cette horloge de précision et le changement climatique provoque déjà d’imprévisibles à-coups sur la délicate mécanique [4].

La première année de la vie benthique d’une huître juvénile est alors semée d’embûches, entre la recherche d’un habitat stable, la compétition avec d’autres organismes voisins, la prédation quotidienne, les virus et parasites endémiques et émergents…
- Une nutrition optimale. Les huîtres se nourrissent par filtration de matière en suspension dans la colonne d’eau dont elles extraient du phytoplancton. Une huître adulte peut filtrer entre 5 et 10 litres d’eau par heure dont elle retient les particules supérieures à 4-5 µm. Le printemps est la saison où elle engraisse, grandit et met beaucoup d’énergie dans sa reproduction : il faut donc que le phytoplancton soit riche et diversifié à cette période [6].
- Des conditions physico-chimiques particulières : une salinité optimale (30 – 35 PSU), une température de l’eau minimum en hiver autour de 6°C et maximum en été autour de 28°C, une eau peu turbide rarement au-dessus de 50 mg/L de matière en suspension [7].
- Une distribution particulière. Les deux espèces se partagent équitablement le milieu côtier : l’huître creuse vit dans la zone de balancement des marées alors que l’huître plate affectionne le bas d’estran et les petits fonds situés entre 0 et 5 mètres ; elle devient rare au-delà de 10 mètres de fond.
Dans ces conditions optimales, la croissance est continue tout au long de la vie de l’animal, les huîtres peuvent dépasser 20 cm et ont des longévités de plusieurs dizaines d’années : le record d’une huître plate au Pays de Galles est de 34 ans !
1.2. Leçon d’écologie : l’union fait la force

Ces organismes bâtisseurs dits « ingénieurs de l’écosystème » construisent donc eux-mêmes leur habitat. Selon la classification du réseau Natura 2000 [8], l’habitat crée par les huîtres porte le nom de « récif biogénique » (Habitat 1170). Or, ces récifs sont de véritables mini-forêts sous-marines fournissant habitats, protection et nourriture à de nombreuses autres espèces marines. Ils œuvrent aussi pour la propreté et la résilience de l’écosystème. Mais le mécanisme est lent, un peu comme pour les coraux : il prend des années, voire des dizaines d’années (Figure 4).
Si les récifs d’huîtres creuses sont très présents sur nos côtes, 50 ans après l’introduction de l’espèce, les bancs et récifs d’huîtres plates (l’espèce native) constituent un habitat marin en danger critique d’extinction sur toutes les côtes européennes [9]. De façon originelle, ces récifs constituaient de vastes étendues sous-marines dans toutes les mers d’Europe, mais ils ont quasiment disparu après 4 siècles d’exploitation acharnée. On parlait alors « d’Oyster Ground » en anglais ou « d’Huitrières » en français. Il est d’ailleurs surprenant de constater que ces termes ont disparu de notre langage au fil des générations et de leur destruction (Figure 5). (Lire Biodiversité sur les côtes rocheuses : zonation et relations écologiques).

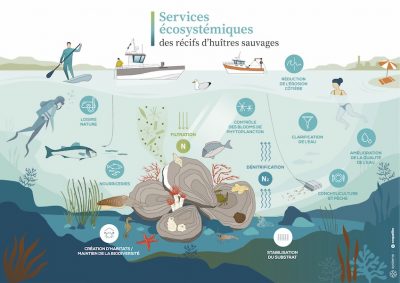
On peut les regrouper en 4 grandes catégories :
- des services de supports : création d’habitats et maintien de la biodiversité marine :
- Le substrat dur des coquilles permet la fixation de nombreux organismes benthiques sessiles : bryozoaires, tuniciers, éponges, annélides, macro-algues s’y installent généreusement (Figure 7). [10]
- Cette canopée offre un refuge à de nombreux invertébrés (gastéropodes, bivalves, petits crustacés, échinodermes) et ce fourmillement attire les petits organismes pélagiques (poissons et céphalopodes) des alentours. Tous ces organismes s’y alimentent et y pondent leurs œufs. Les récifs jouent donc des rôles essentiels de nourricerie et de nurseries.

- des services de régulation : Mais leurs compétences d’ingénieur ne s’arrêtent pas là :
- Ces massifs biogéniques jouent le rôle de puissants filtres biologiques qui, sans relâche, épurent la colonne d’eau de toute la matière en suspension (bonne ou mauvaise) et contribuent activement à la régulation des cycles biogéochimiques naturels : filtration, dénitrification, épuration, clarification 24h sur 24. Ils sont « la pompe et le filtre de l’aquarium » des milieux côtiers, discrets, silencieux, besogneux et essentiels…
- De plus, leurs structures cohésives permettent aussi la stabilisation des sédiments, l’atténuation des vagues et la réduction des courants laminaires de fond. Ces barrières physiques structurent les paysages côtiers et sous-marins et favorisent à proximité, l’installation voisine d’habitats plus fragiles et/ou nécessitant des eaux claires, notamment les herbiers de zostère et les bancs de maërl.
- des services de production;
- Produits vivriers utilisés par l’homme (pêche et aquaculture) ;
- Matériaux bruts coquilliers pour l’agriculture (amendement calcaire) et désormais l’industrie (Oysterprene®, kaolin et verre à base d’huîtres, béton coquillier, Geocorail®, etc.).
- des services culturaux : enfin, un peu comme le vin et les vignobles, l’huître contribue à l’écotourisme (route de l’huître, fête de l’huître et même trail de l’huître !), diversifie et valorise les paysages côtiers et supporte des activités récréatives (chasse en plongée, pêche à pied) mais aussi des activités pédagogiques (aires marines éducatives).
2. Des colosses géologiques au pied d’argile
Si le recrutement des jeunes huitres échoue plusieurs fois de suite, la population décline et peut disparaître surtout si d’autres facteurs défavorables s’en mêlent comme les pressions anthropiques multiples et variées. Dans ce cas particulier d’espèces-ingénieurs d’écosystème, les répercussions en cascade affectent la distribution, la structure des communautés, la biodiversité et parfois l’écosystème en entier. Par contre, dès que les conditions redeviennent favorables à la vie larvaire et au recrutement, la forte fécondité individuelle, caractéristique de ces espèces, est un atout qui peut les aider à reconstituer assez rapidement de nouvelles populations surtout si l’homme les aide un peu.
2.1. Des menaces locales identifiées et maîtrisables

En luttant contre ces menaces identifiées sur lesquelles on peut « facilement agir » localement et en offrant des zones de repos biologique, certaines politiques de restauration d’habitats sous-marins sont ainsi envisageables pour favoriser le rétablissement d’anciens bancs d’huîtres plates et rendre ainsi l’écosystème plus résilient (voir 3.2).
2.2. Une menace globale, sournoise et incontrôlable
Parmi les menaces plus globales figure bien sûr celle des pollutions chroniques (Lire L’huître, cette sentinelle témoin d’un littoral à préserver), mais surtout celle liée au réchauffement climatique et l’acidification des océans.
L’océan absorbe plus de 90% de l’excès de chaleur et plus de 30% des émissions de dioxyde de carbone (CO2) atmosphérique. Il joue donc un rôle essentiel de régulateur du climat à l’échelle mondiale. Le revers de la médaille est que l’océan de surface (0-300 m) s’est réchauffé d’environ 0,11°C par décennie depuis 1971. En parallèle, le CO2 interagit avec l’eau de mer, se transforme en acide carbonique et engendre lentement « l’acidification des océans », le dangereux compagnon du changement climatique.
Selon le scénario le plus pessimiste du Groupe d’Experts Intergouvernemental sur l’Évolution du Climat (GIEC ; RCP 8.5), la température pourrait augmenter d’environ 4°C d’ici la fin du siècle et le pH (potentiel hydrogène) de l’océan global, actuellement de 8,1, pourrait encore diminuer de 0,32 unités, ce qui correspondrait à une augmentation de son acidité de 110%. Or, ces modifications ont un impact direct sur la biologie de l’huitre.
Les huîtres face au réchauffement des océans. Animal ectotherme, l’huître ne régule pas sa température interne et dépend des conditions thermiques de son environnement. L’huître plate initie sa reproduction dès que les masses d’eau dépassent 17°C, l’huître creuse attend les 18-19°C. Pour les deux espèces, l’eau plus chaude en été favorisa le développement larvaire :
- Les « canicules bretonnes » sont pour l’instant favorables à la reproduction de l’huître plate et pourraient donc faciliter les opérations de restauration écologique à venir.
- Pour l’huître creuse, d’un point de vue biogéographique, 50 ans après son introduction, la reproduction est maintenant possible un peu partout en Europe… jusqu’en Norvège. Cela représente un déplacement de 1400 km vers le nord depuis son point d’introduction en France [13]. Ainsi en rade de Brest, les pontes et la survie de la progéniture sont désormais facilitées, et des exercices de modélisations biologiques pour 2100 [14] indiquent même qu’il pourrait y avoir deux périodes de ponte, une précoce et une tardive dans cet écosystème tempéré où l’huître n’était pas censée se reproduire à l’époque de son introduction.
Donc sur la côte atlantique, on pourrait dire que jusque-là, pour ces deux espèces, tout va bien.
Mais sur la côte méditerranéenne, les canicules des dernières années inquiètent un peu plus les scientifiques. Ainsi, dans la lagune de Thau – le principal site ostréicole de Méditerranée-, lors des canicules de 2018 et 2019, l’eau a atteint une salinité record de 42 PSU et une température frôlant les 30°C associée à une baisse des concentrations en oxygène dissous dans l’eau [15]. Très proches des limites physiologiques de l’huître creuse, ces conditions déstabilisent les biocénoses benthiques et modifient les communautés planctoniques dont l’huitre se nourrit. Elles favorisent par exemple des espèces de très petite taille tolérant ces grandes variations environnementales. Or ces espèces planctoniques sont sans intérêt alimentaire pour l’huître provoquant ainsi un arrêt de leur croissance, un amaigrissement et une mortalité accrue [16]. Ici, le changement climatique menace donc directement l’ostréiculture !
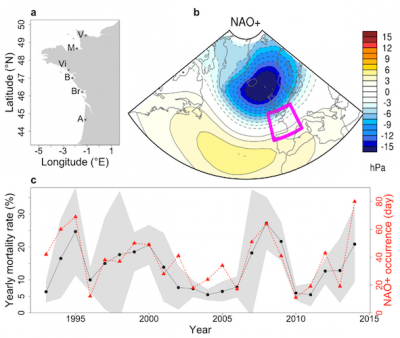
Les huîtres face à l’acidification des océans. Une hausse de l’acidité de l’eau réduit la disponibilité du carbonate de calcium qui est une brique minérale essentielle utilisée par les organismes calcifiants, comme les huîtres, pour fabriquer leurs coquilles. Une acidification sévère pourrait même entraîner la dissolution de ces coquilles. Les eaux littorales, peuplées par nos coquillages favoris, sont naturellement plus acides et variables en pH que la pleine mer, mais elles pourraient le devenir de façon accrue et permanente. Actuellement, les huîtres sont parfois déjà confrontées à des pH de 7,7 en rade de Brest.

Les répercussions du pH sur l’huître plate (native, qui vit en permanence dans l’eau), déjà très fragilisée, restent mal connues.
Par contre, pour les deux espèces, le stade larvaire pourrait constituer une phase beaucoup plus sensible : par exemple, sur la larve de C. gigas, un ralentissement de la croissance et une diminution de la survie sont observés dès que le pH passe en dessous de 7,6. Cette valeur critique est déjà atteinte dans certaines régions du globe, comme par exemple sur la côte ouest des États-Unis, où les scientifiques et les conchyliculteurs ont mis en évidence une forte corrélation entre l’acidité de l’eau et la mortalité des larves d’huître creuse [20], les forçant à développer des stratégies pour s’y adapter.
3. Concilier conservation, restauration écologique et usages
3.1. Un observatoire national pour anticiper les effets du climat sur l’huître creuse

3.2. Une démarche mondiale et une alliance européenne pour sauver l’huître plate
Le changement climatique a un impact grandissant sur les écosystèmes, mais l’érosion de la biodiversité et la dégradation accrue des milieux réduisent leurs résistances et les fragilisent encore plus. En parallèle des mesures de réduction des émissions de CO2, des solutions fondées sur la nature offrant plus de résilience se révèlent être aussi des réponses complémentaires à apporter.
La dégradation des fonds marins, la mécanisation de la pêche, les pollutions, l’érosion massive des sols et l’augmentation de la sédimentation des estuaires, sans oublier l’introduction d’espèces allochtones parfois invasives ou pathogènes, font reculer ou disparaître les espèces natives et leurs habitats (Lire L’huître, cette sentinelle témoin d’un littoral à préserver). Dans un tel contexte, la biologie de la conservation et l’écologie de la restauration sont aussi devenues des thématiques de recherche multidisciplinaires essentielles en milieu marin notamment depuis la Directive Habitat de l’Europe en 1992.
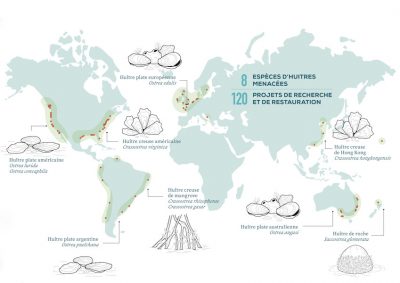
En France, l’huître plate, seule huître native et endémique d’Europe, a longtemps été oubliée par le code de l’environnement. Depuis 1992, la Directive Européenne Habitat Faune Flore prévoit « le maintien d’un état favorable des habitats voire leur restauration » et depuis 2008, la convention OSPAR [22] (Oslo-Paris) liste les récifs d’huîtres plates comme un habitat « en danger critique d’extinction ». Pour autant, en 2021, la restauration écologique de cette espèce et de son habitat n’est encore qu’à son balbutiement mais les choses bougent un peu [23].

4. Messages à retenir
- Les huîtres, présentes sur nos côtes depuis des millions d’années, pourraient bien grossir la liste des espèces menacées par l’Homme ;
- Ces organismes marins, peu photogéniques, révèlent une biologie bien plus complexe qu’il n’y parait, notamment dans leur stratégie de reproduction, qui leur permet de coloniser rapidement un milieu quand les conditions sont favorables ;
- Les huîtres jouent un rôle d’espèce architecte, d’ingénieur d’écosystème, de supports de biodiversité et de fournisseurs de nombreux services de régulation (filtres biologiques épurant la colonne d’eau, stabilisation des sédiments, structuration des paysages côtiers et sous-marins) ;
- La résilience que ces forteresses biogéniques apportent au milieu marin, est un précieux outil d’adaptation et d’atténuation face aux pressions du changement climatique.
- La poursuite de la mondialisation favorisera l’émergence de nouveaux pathogènes, de parasites et de prédateurs, et l’inertie inhérente à la machine climatique entraînera des répercussions séculaires sur le maintien des écosystèmes où vivent les huîtres ;
- Dans ce contexte, la solution pragmatique de protéger, voire de restaurer, une partie de la surface du globe (un chiffre d’or autour de 30 % à l’horizon de 2030 [25]) constitue un objectif facilement transposable à nos milieux côtiers, assez aisé à comprendre collectivement et à consolider ensemble pour garder l’intégrité régionale et planétaire ;
- La restauration active des huitrières fait partie d’un ensemble, d’une stratégie d’avenir, celle des solutions fondées sur la nature [26] promue par l’IUCN ;
- Au même titre que l’abeille en milieu terrestre, que l’ours blanc en milieu polaire, que les récifs coralliens en milieu tropical, l’huître joue le rôle d’une victime, d’une sentinelle et d’un lanceur d’alerte pour le milieu côtier de nos latitudes tempérées. Il nous suffit de « l’écouter » pour éviter d’être « tel est pris qui croyait prendre ».
Notes et Références
Image de couverture. Fragile colonie récifale d’huître plate au cœur d’une ancienne huîtrière détruite au 19e siècle et désormais en voie de renaturation en rade de Brest [Source : © IFREMER / Stéphane Pouvreau]
[1] L’huitre plate, Ostrea edulis, est localement appelée Belon (sud Bretagne), Gravette (Arcachon) ou Pied de Cheval (pour celles sauvages qui ont pu grossir).
[2] Ces structures sont appelées « spermatozeugmata » ; SUQUET, M. et al. (2018). Biological characteristics of sperm in European flat oyster (Ostrea edulis). Aquatic Living Resources, 31, 20 (7p).
[3] Duchene, J., Bernard, I., Pouvreau, S. (2015). Vers un retour de l’huître indigène en rade de Brest. Espèces, 16, 51-57.
[4] Pouvreau, S. et al. (2021). Inventaire, diagnostic écologique et restauration des principaux bancs d’huitres plates en Bretagne : le projet FOREVER. Ifremer. Rapport Final. Contrat FEAMP 17/ 2215675.
[5] Petton, S., Pouvreau, S., Dumas, F. (2020). Intensive use of Lagrangian trajectories to quantify coastal area dispersion. Ocean Dynamics, 70, 4, 541-559 .
[6] Bernard, I., De Kermoysan, G., Pouvreau, S. (2011). Effect of phytoplankton and temperature on the reproduction of the Pacific oyster Crassostrea gigas: investigation through DEB theory. Journal of Sea Research, 66, 349-360.
[7] Surtout pour l’huître plate qui n’apprécie ni la turbidité, ni la sédimentation.
[8] http://www.natura2000.fr/outils-et-méthodes/guides-ouvrages/cahiers-habitats
[9] Pouvreau, S. et al. (2021). Current distribution of the residual flat oysters beds (Ostrea edulis) along the west coast of France. SEANOE. https://doi.org/10.17882/79821
[10] La coquille de l’huître plate est particulièrement feuilletée et offre une capacité de support quatre fois plus riche qu’un substrat dur minéral standard mais aussi deux fois plus que sa cousine introduite.
[11] Bosseboeuf, L. (2019). Étude de la variation des ressources marines en rade de Brest : 1866-1963. Projet HistoRade. Univ. Bretagne Occidentale, Rapport de Master 2. 80p.
[12] Les bigorneaux perceurs sont des petits gastéropodes qui forent des trous dans la coquille des bivalves pour se nourrir de leur chair. L’action de leur langue râpeuse combinée à la sécrétion d’enzymes leur permet de percer un petit trou circulaire bien caractéristique en quelques heures (voire deux jours pour les coquilles les plus épaisses). Il existait une espèce native, le cormaillot Ocenebra erinacea, mais les deux espèces malencontreusement introduites au cours du 20e siècle, Urosalpinx cinerea mais surtout Ocinebrellus inornatus, sont beaucoup plus voraces.
[13] Thomas, Y. et al. (2016). Global change and climate-driven invasion of the Pacific oyster (Crassostrea gigas) along European coasts: a bioenergetics modelling approach. Journal of Biogeography 43, 3, 568-579.
[14] Gourault, M. et al. (2019). Modeling reproductive traits of an invasive bivalve species under contrasting climate scenarios from 1960 to 2100. Journal of Sea Research 143, 128–139
[15] Fleury, E. et al. (2020). Observatoire national du cycle de vie de l’huître creuse en France – Année 2019. Rapport Annuel de Contrat Convention DPMA – Ifremer. 71 p.
[16] Lagarde, F. et al. (2021). Phénomène d’Eaux Vertes à Picochlorum en lagune de Thau pendant les années 2018 et 2019, Observations environnementales. RST Ifremer ODE/UL/LERLR21/15. In press
[17] Thomas, Y., Cassou, C., Gernez, P., Pouvreau, S. (2018). Oysters as sentinels of climate variability and climate change in coastal ecosystems. Environmental Research Letters 13, 104009 (12p.)
[18] Merou, N. (2021). Étude de l’écologie de Marteilia refringens et Bonamia ostreae, deux parasites protozoaires de l’huître plate, Ostrea edulis. Thèse Univ. La Rochelle. 246 p.
[19] Lutier, M. et al. (2021) Revisiting tolerance to ocean acidification: insights from physiological, biochemical, and molecular tipping points of a marine calcifier. in prep.
[20] Barton, A. (2012). The Pacific oyster, Crassostrea gigas, shows negative correlation to naturally elevated carbon dioxide levels: Implications for near-term ocean acidification effects. Limnology and Oceanography 57, 698–710.
[21] Réseau sur la reproduction et le recrutement (VELYGER) : http://wwz.ifremer.fr/velyger & Réseau sur la croissance et la survie (RESCO) : https://wwz.ifremer.fr/observatoire_conchylicole/
[22] La Convention pour la protection du milieu marin de l’Atlantique du Nord-Est ou Convention OSPAR (OSPAR pour « Oslo-Paris ») définit les modalités de la coopération internationale pour la protection du milieu marin de l’Atlantique du nord-est. Elle est entrée en vigueur le 25 mars 1998, et remplace les Conventions d’Oslo et de Paris. https://www.ospar.org/
[23] ANONYME (2018). Document stratégique de la façade Nord Atlantique – Manche Ouest. Annexe 6 : objectifs stratégiques et indicateurs associés. Rapport Direction inter-régionale de la mer Nord Atlantique-Manche Ouest. 295 pp.
[24] Pogoda, B. et al. (2019). The Native Oyster Restoration Alliance (NORA) and the Berlin Oyster Recommendation: bringing back a key ecosystem engineer by developing and supporting best practice in Europe. Aquatic Living Resources, 32, 13 (9p).
[25] Sala E. et al. (2021) Protecting the global ocean for biodiversity, food and climate. Nature. 592, pages 397-402
[26] https://uicn.fr/solutions-fondees-sur-la-nature/
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : POUVREAU Stéphane, DI POI Carole, FLEURY Elodie, LAGARDE Franck (15 septembre 2021), Les huîtres : ces architectes méconnus des milieux côtiers , Encyclopédie de l’Environnement. Consulté le 27 juillet 2024 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/vivant/huitres-meconnus-milieux-cotiers/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.







