Impacts de l’agriculture sur la biodiversité et le fonctionnement des écosystèmes
PDF
Depuis ses débuts au Néolithique, l’expansion de l’agriculture s’est accompagnée d’innovations techniques qui ont progressivement augmenté les rendements agricoles et permis la croissance de la population humaine mondiale au fil des siècles, semblant repousser indéfiniment les limites de productivité des agrosystèmes et de la biosphère. Où en est aujourd’hui cette dynamique ? Peut-on prendre la mesure des impacts de l’agriculture sur la biodiversité et le fonctionnement des (socio-)écosystèmes, à l’échelle mondiale ? Quels enseignements pour le futur ?
- 1. Le paradoxe d’Ouroboros
- 2. Impacts sur la biomasse végétale et la productivité des écosystèmes terrestres
- 3. Capacité d’accueil des habitats, abondance des communautés d’espèces sauvages
- 4. Composition des communautés d’espèces sauvages
- 5. Impact sur le nombre d’espèces locales
- 6. Impact sur la biodiversité mondiale, en nombre d’espèces
- 7. Impacts sur la structure et le fonctionnement des réseaux écologiques
- 8. Impacts sur la stabilité des agrosystèmes
- 9. Impacts sur le fonctionnement des écosystèmes
- 10. Quel futur pour Ouroboros ?
- 11. Messages à retenir
1. Le paradoxe d’Ouroboros
Dans l’ancienne Égypte, il y a plus de 3500 ans, tombeaux et papyrus étaient souvent ornés d’un serpent qui se mord la queue, formant une boucle circulaire (Figure 1).

Cet Ouroboros symbolise aussi l’idée de paradoxe, ou d’action impossible, parce qu’il se nourrit de lui-même. Et dans la langue française actuelle, l’expression « un serpent qui se mord la queue » désigne un cercle vicieux, « une succession de problèmes dont on ne voit pas la fin ». Ce paradoxe d’Ouroboros semble s’appliquer aujourd’hui aux sociétés humaines confrontées à l’agriculture, tout à la fois nourricière et destructrice.
Aux trois facteurs de développement de l’agriculture : (i) expansion spatiale, (ii) progrès techniques des pratiques agricoles et (iii) sélection-domestication de populations animales et végétales plus productives, s’est ajoutée (iv) la transformation puis mondialisation des systèmes agroalimentaires, et des chaînes marchandes associées à l’agriculture.
Cependant, s’exerçant sur des socio-écosystèmes dynamiques, formés de multiples espèces (dont des humains) en interaction dans leur milieu de vie, ces facteurs de développement et évolution de l’agriculture sont tout autant de pressions -ou facteurs d’impact- sur ces systèmes (Lire focus Quels sont les grands facteurs d’impact agricole ?), qui interagissent dans une dynamique/spirale ‘ouroborienne’.
2. Impacts sur la biomasse végétale et la productivité des écosystèmes terrestres
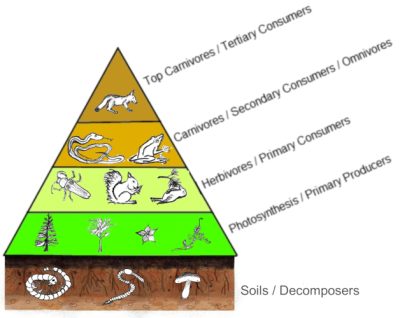
La production primaire annuelle d’un écosystème est la biomasse des organismes autotrophes produite chaque année par cet écosystème. Sa productivité est égale au taux de production de biomasse, par unité de surface et de temps. Située à la base des réseaux trophiques, ou ‘chaînes alimentaires’, cette production primaire conditionne la production globale et le fonctionnement des écosystèmes.
Si l’on excepte le cas de la vallée du Nil et de quelques autres régions désertiques de surface restreinte, la conversion d’habitats terrestres « naturels » ou « semi-naturels » tels que forêts et marais en pâturages et champs cultivés se solde par une réduction nette de la biomasse et de la productivité végétales des écosystèmes concernés.
A l’échelle de la Planète, Erb et al. [1] estiment que les changements d’usage des terres opérés par les humains depuis le Néolithique ont réduit de moitié (environ 450 Gigatonnes de Carbone (Gt C)) la biomasse totale des plantes terrestres. Plus des deux tiers de cette perte de biomasse peuvent être imputés à l’agriculture, le reste à l’exploitation des forêts et à l’artificialisation des sols.
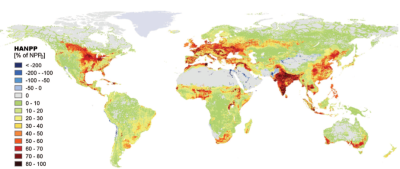
Quant à la production végétale annuelle des habitats terrestres, elle est réduite d’environ 10% à l’échelle mondiale [2] depuis les débuts de l’agriculture, du fait des changements d’usage des terres. En outre, environ 20% de cette production végétale terrestre est accaparée chaque année par les humains via l’agriculture, avec de grandes variations entre régions (Figure 3).
3. Capacité d’accueil des habitats, abondance des communautés d’espèces sauvages
Si les forêts et autres habitats naturels hébergent des réseaux d’espèces complexes et diversifiés, les agrosystèmes dédiés à la culture d’une seule ou d’un petit nombre d’espèces domestiques comportent par construction moins d’individus d’espèces sauvages que les habitats naturels alentour. L’agriculture intensive réduit la capacité d’accueil des parcelles cultivées pour les espèces sauvages de multiples manières : via la suppression physique des arbres et haies, l’érosion du sol, l‘élimination des plantes messicoles, les traitements insecticides, antibiotiques ou antifongiques, le drainage des eaux de surface, la pollution ou salinisation éventuelle des sols, etc. Ainsi, la conversion d’habitats (semi-)naturels en systèmes d’agriculture intensive réduit considérablement la capacité biotique de ces habitats pour les communautés d’espèces sauvages, en nombre d’individus.

A l’échelle mondiale, s’appuyant sur les estimations de surface des grands types de biomes terrestres en 1990 par Klein-Goldjewijk [4], Gaston et al. [3] ont estimé à environ 30 milliards d’oiseaux, soit entre 20 et 25% des effectifs préagricoles, la réduction de l’avifaune mondiale ‘terrestre’ (oiseaux de mer exclus) due à l’expansion et l’intensification de l’agriculture, du Néolithique à 1990.
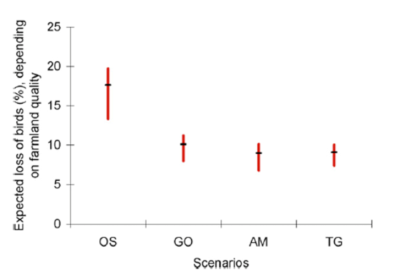
En appliquant ces estimations de densité d’oiseaux par habitat aux quatre scénarios de changements d’usage des terres développés à l’horizon 2050 à l’échelle mondiale par le Millenium Ecosystem Assessment (MEA) [5], Teyssèdre & Couvet [6] ont estimé la perte de l’avifaune terrestre mondiale liée à l’expansion et l’intensification de l’agriculture attendue en 2050 à 10 à 25% des effectifs de 1990, selon le scénario d’usage des terres envisagé (Figure 5). Sans surprise, le scénario le plus défavorable pour la biodiversité est celui, dit ‘d’Ordre par la force’ (‘Order from strength’), d’une gestion réactive et régionalisée des écosystèmes, sans anticipation ni collaboration interrégionale.
Cela revient à une réduction de 27 à 45% du nombre d’oiseaux nicheurs, des débuts de l’agriculture à 2050, selon le scénario envisagé. Une perspective plutôt sombre, si l’on considère que les trajectoires de développement socioéconomique actuelles s’apparentent au scénario le plus défavorable du MEA ! (cf. GIEC [7]).
De ce fait, ils constituent un bon indicateur de biodiversité terrestre, reconnu au plan international par la Convention pour la Diversité Biologique (CDB) depuis 2004 [8] (et voir plus loin la Figure 7). Bien que de façon moins systématique, collaborative et standardisée, les variations d’abondance d’autres groupes d’organismes ont été suivies à l’échelle locale par de nombreux chercheurs (voir plus bas), en de nombreux sites géographiques, qui confirment et renforcent les résultats obtenus sur l’avifaune.
Comme tous les écosystèmes, les agrosystèmes sont des systèmes ouverts, en interaction avec leur environnement et les paysages alentour. Si les impacts directs de l’agriculture ‘extensive’ sur la biodiversité sont essentiellement locaux, c’est-à-dire restreints aux écosystèmes convertis pour l’agriculture, ceux de l’agriculture intensive dépassent largement les limites des champs cultivés, via la dispersion des polluants. Transportés par l’air, les eaux de surface ou les animaux mobiles (insectes, vertébrés…), les composés chimiques appliqués localement atteignent et affectent les écosystèmes adjacents, voire éloignés. Ainsi les pollutions par les engrais et pesticides déversés sur les champs et lessivés lors des pluies, ou gagnant les nappes phréatiques, sont nocives pour les écosystèmes de tout type en aval.
La pollution des littoraux par les engrais azotés utilisés massivement dans certaines régions est bien connue, qui s’exprime par des blooms algaux récurrents (dits ‘marées vertes’), délétères pour la biodiversité, et peut transformer certaines zones humides, estuaires et écosystèmes littoraux en zones « mortes » privées d’espèces aérobies (Figure 6).

A l’échelle mondiale, compilant les données de 166 suivis d’abondance d’insectes sur tous les continents (1676 sites), van Klink et al. [13] ont estimé un déclin moyen de l’abondance des insectes terrestres moins sévère (d’environ 1% par an), largement imputé à l’intensification de l’agriculture.
4. Composition des communautés d’espèces sauvages
Dans une communauté biotique formée d’espèces similaires – communauté locale de poissons ‘herbivores’ par exemple, ou d’insectes phytophages, ou d’arbres…-, toutes les espèces n’ont pas les mêmes aptitudes et exigences écologiques. Elles ne réagissent donc pas de la même manière aux variations spatiales ou temporelles de leur habitat (Lire ‘Quelles réponses de la Biodiversité aux changements globaux ?’).
Dès lors, la transformation d’habitats pour l’agriculture, non seulement réduit généralement l’abondance des communautés biotiques locales, mais affecte aussi leur composition. Par exemple, la conversion de forêts en champs et pâturages remplace les communautés initiales forestières, dominées par des espèces spécialistes des forêts, par des communautés ‘agricoles’ dominées par des espèces spécialistes des prairies et autres milieux ouverts. L’intensification de l’agriculture, ainsi que la fragmentation d’habitats (semi)naturels pour l’agriculture, défavorise les espèces spécialistes et augmente la proportion de généralistes.

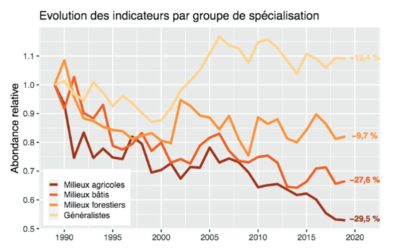
Que ce soit chez les oiseaux, les insectes (Figure 8) ou d’autres taxons, de nombreux suivis de biodiversité soulignent la raréfaction des espèces spécialistes dans les sites étudiés, attribuée principalement à l’intensification de l’agriculture, à la pollution et au réchauffement climatique (e.g. [10] et [15]).
A l’échelle des paysages et régions, l’expansion d’espèces généralistes (éventuellement originaires d’autres régions du Globe) ou/et commensales des humains, associée au déclin d’espèces spécialistes, se traduit par une ressemblance croissante des communautés écologiques, dite ‘homogénéisation fonctionnelle’, manifeste notamment dans les régions d’agriculture intensive ([15], [16]).
5. Impact sur le nombre d’espèces locales
Si l’on assume que le nombre d’espèces -ou ‘richesse spécifique’- d’une communauté biotique augmente avec son abondance en nombre d’individus [17], on peut s’attendre à ce que l’expansion et l’intensification de l’agriculture, en réduisant l’abondance des communautés locales d’espèces sauvages, réduise également leur diversité (locale, dite ‘alpha’) en nombre d’espèces.
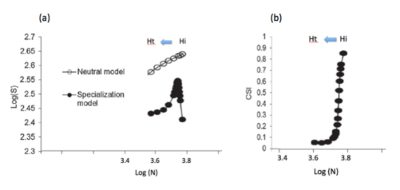
Cela s’explique simplement si l’on considère que le déclin d’espèces spécialistes, en nombre d’individus, ne signifie pas leur disparition immédiate locale. A l’inverse, la colonisation par de nouvelles espèces généralistes d’un habitat transformé implique à la fois une augmentation en nombre d’espèces et d’individus (généralistes). Schématiquement, le nombre total d’espèces locales augmente, avec la perturbation des habitats, tant que la colonisation par de nouvelles espèces généralistes excède la disparition locale d’espèces spécialistes ; puis il diminue lorsque cette dernière excède l’apport d’espèces généralistes.
En bref, contrairement à leur index de spécialisation, la richesse spécifique des communautés locales ne peut constituer un bon indicateur de stabilité ou ‘qualité’ des habitats, notamment agricoles, puisqu’elle augmente ou diminue selon le degré de perturbation. Ce prédicat théorique est confirmé par les suivis d’avifaune [16] et par d’autres suivis de biodiversité, en milieu terrestre ou aquatique. Une méta-analyse de suivis de biodiversité menés à l’échelle locale ou régionale depuis plus de 30 ans [19] montre un changement de la composition des communautés au fil du temps et confirme l’érosion de la biodiversité à l’échelle globale, mais n’observe aucune tendance générale à la diminution du nombre d’espèces locales (voir aussi Teyssèdre & Robert [20]).
6. Impact sur la biodiversité mondiale, en nombre d’espèces

Face au manque de connaissances sur la diversité mondiale des bactéries, archées, protistes, ‘algues’ et champignons, il est difficile d’estimer l’impact de l’agriculture sur le nombre total d’espèces dans ces vastes règnes du Vivant. Le même constat s’applique à la plupart des grands groupes animaux, à l’exception de trois groupes plus largement étudiés, les insectes, les mammifères et les oiseaux.
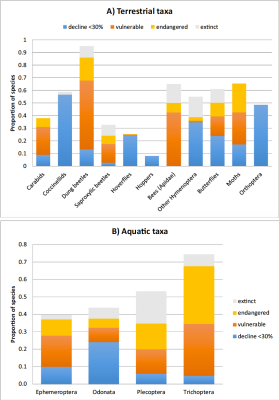
Pour les vertébrés, l’UICN [22] estime que 26% des espèces de mammifères, 14% des espèces d’oiseaux et 41% des espèces d’amphibiens sont actuellement menacées d’extinction, sous la pression des mêmes facteurs –anthropiques- identifiés ci-dessus pour les insectes.
7. Impacts sur la structure et le fonctionnement des réseaux écologiques
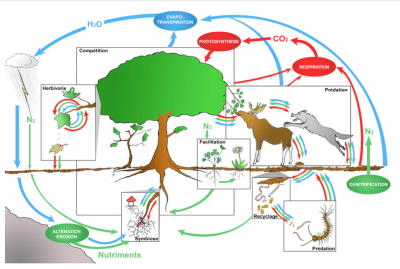
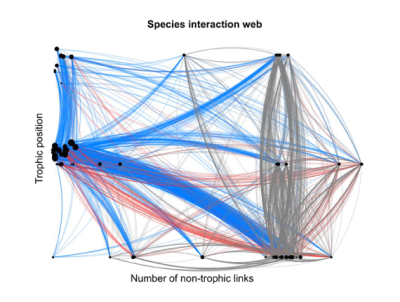
Dans un écosystème peu anthropisé, les interactions entre espèces sont habituellement multiples, anciennes et diversifiées : relations trophiques bien sûr, entre prédateurs et proies ou entre espèces-hôtes et parasites (ou parasitoïdes), de la base au sommet des ‘chaînes alimentaires’ ; mais aussi relations de compétition pour les ressources, de facilitation (à l’installation d’autres espèces) ou encore d’entraide réciproque, entre espèces de niveaux trophiques variés (e.g. Couvet & Teyssèdre [23], et Figure 12).
Parmi les relations de coopération, ou entraide réciproque, citons les associations nutritives entre plantes et bactéries (Rhizobium dans les racines) ou entre plantes et champignons (ex : mycorhizes), les services échangés entre plantes à fleurs et insectes pollinisateurs (alimentation vs reproduction), entre espèces parasitées et prédateurs de parasites (alimentation ou gîte vs protection), la dispersion de graines par des insectes, oiseaux et mammifères (granivores ou frugivores), etc. La répétitivité des interactions contribue au fil du temps à la coadaptation (et synchronisation) des espèces partageant les mêmes habitats, tandis que leur diversité concourt à la stabilité des réseaux écologiques [24] (Figure 13). [25]
La diversité des organismes détritivores, coprophages, saprophytes et recycleurs est à son tour réduite et largement délocalisée hors des champs, dans les lisiers des bâtiments d’élevage, les égouts, les stations d’épuration et les plans d’eau ou littoraux en aval.
8. Impacts sur la stabilité des agrosystèmes
Les recherches réalisées depuis plus de 50 ans ont permis de vérifier que, au moins à l’échelle locale, le fonctionnement et la stabilité des écosystèmes terrestres augmentent avec la diversité des plantes qu’ils hébergent [26].

- Diversité génétique des espèces cultivées (e.g. [27]),
- Diversité spécifique et fonctionnelle des espèces cultivées (polyculture vs monoculture) et non cultivées (e.g [27] et [28]),
- Abondance des pollinisateurs (e.g. [29]),
- Diversité des niveaux trophiques, notamment présence locale d’ennemis naturels (prédateurs, parasitoïdes..) des parasites et autres ‘ravageurs’ des cultures, éventuellement issus d’autres habitats alentour (e.g. [30]),
- Diversité des interactions non trophiques (dont facilitation, e.g. [30], [31]),
- Ancienneté des interactions (coadaptation, e.g. [31]),
- Diversité locale par rapport à la diversité régionale, et diversité des cultures à l’échelle nationale (e.g. [29]),
- Diversité des réseaux agriculteurs – variétés cultivées (e.g. [32]).

9. Impacts sur le fonctionnement des écosystèmes
Les impacts de l’agriculture sur la structure et la dynamique des communautés, les nombres d’espèces et les réseaux écologiques, à différentes échelles, affectent le fonctionnement des écosystèmes et socio-écosystèmes (voir par ex. [5]). Outre la simplification des réseaux écologiques et écosystèmes locaux, un autre effet de l’agriculture est de les spécialiser dans la production de biomasse exploitable par les humains, au détriment d’autres fonctions (Figure 16).
Parmi les multiples fonctions écosystémiques entravées par l’expansion et l’intensification de l’agriculture, citons :
- L’épuration de l’air par les forêts et autres écosystèmes (semi-)naturels terrestres
- La capture et séquestration du carbone par ces mêmes écosystèmes, et donc la régulation du climat mondial,
- La régulation du climat local par les forêts et zones humides,
- La modération des crues et sécheresses,
- Le renouvellement des nappes phréatiques,
- L’épuration des eaux douces, avec un impact en aval sur l’ensemble du bassin versant,
- L’entretien et la productivité des sols aujourd’hui réduite par l’érosion, les pollutions, la salinisation, …,
- La pollinisation des plantes sauvages et cultivées par les abeilles et autres insectes pollinisateurs en déclin,
- La résistance des communautés sauvages et cultivées aux invasions de parasites et autres pathogènes,
- La capacité d’accueil des écosystèmes pour les espèces sauvages, notamment spécialistes,
- Leur capacité d’accueil physique et psychologique pour les animaux domestiques ou d’élevage (confinés en grand nombre dans des bâtiments agricoles),
- Leur capacité de recyclage des déchets, alimentaires (dont fèces) et agro-industriels (dont matières plastiques, métaux…),
- Leur capacité d’accueil pour les humains.
Sans explorer ici les impacts des progrès techniques, des modèles de production et consommation, des systèmes de taxation/subventions ou du commerce international sur l’évolution des systèmes agroalimentaires, soulignons que les multiples impacts sur le fonctionnement des écosystèmes énoncés ci-dessus affectent non seulement la biodiversité non humaine, mais aussi très largement les populations humaines.
10. Quel futur pour Ouroboros ?

Ainsi, il semble bien que la dynamique « ouroborienne » d’expansion-intensification de l’agriculture ait atteint ses limites. Pour résumer, celle-ci peut être décrite comme un détournement croissant de la productivité primaire (i.e. végétale) des écosystèmes terrestres – et donc leur transformation massive – par certaines sociétés humaines, au « profit » de communautés végétales, animales (dont humains) et microbiennes peu diversifiées, dont la fragilité augmente avec celle des écosystèmes appauvris et pollués qui les hébergent… menaçant ainsi d’effondrement les sociétés qui en dépendent !
Pour subsister, notre vieil Ouroboros doit impérativement revoir son régime et réduire ses appétits (pour les intrants chimiques, les protéines animales et les agrocarburants, notamment). Face aux multiples impacts de cette dynamique agricole, nos sociétés doivent remettre en question les systèmes agricoles dominants et élaborer des politiques et pratiques alternatives, durables, susceptibles de les sortir de cette boucle destructrice pour les écosystèmes et la biodiversité. Politiques agricoles nouvelles [34] qui pour être approuvées et mises en œuvre de façon cohérente doivent s’inscrire dans un changement général de conception, objectifs et organisation des sociétés au sein des socio-écosystèmes, valorisant la diversité écologique (régulatrice), la sobriété (durable) et l’équité environnementale, plutôt que la production et la consommation intensives – et non durables – de « ressources » agricoles.
11. Messages à retenir
- Depuis le Néolithique, l’expansion et l’intensification de l’agriculture ont réduit d’environ un tiers la biomasse végétale des habitats terrestres. En outre, environ 20% de leur productivité primaire (biomasse végétale produite par unité de surface et de temps) est accaparée annuellement par les humains, pour leur alimentation ou d’autres usages, avec de larges variations selon les régions.
- La transformation des habitats pour l’agriculture réduit l’abondance et modifie la composition des communautés d’espèces sauvages : la proportion d’espèces généralistes augmente avec la perturbation des habitats.
- Par ses effets directs et indirects, l’élevage exerce un fort impact sur la biodiversité et les écosystèmes. Ainsi, seuls 3% en biomasse des mammifères sont aujourd’hui sauvages.
- Dans un agrosystème, la diversité des interactions entre espèces diminue avec l’intensité croissante des pratiques agricoles.
- La résistance des agrosystèmes aux perturbations augmente avec la diversité et l’ancienneté des interactions entre espèces et diminue avec l’intensité des pratiques agricoles.
- Le bouleversement massif d’écosystèmes par et pour l’agriculture entrave leur fonctionnement et leur productivité à moyen terme, au détriment des sociétés humaines et de nombreuses espèces.
- Le défi agricole du 21e siècle est immense : atteindre une agriculture durable, de production suffisante, tout en préservant la biodiversité et en atténuant le changement climatique.
—-
Cet article est une version légèrement modifiée du « Regard sur la biodiversité » (R103) de l’auteure, publié en juin 2022 par la Société Française d’Ecologie et d’Evolution (SFE2).
Notes et références
Image de couverture. Champ de maïs. [Source : Cliché © A. Teyssèdre]
[1] Erb K-H et al., 2017. Unexpectedly large impact of forest management and grazing on global vegetation biomass. Nature 553:73–76.
[2] Haberl H., K.H. Erb et al., 2007. Quantifying and mapping the human appropriation of net primary production in earth’s terrestrial ecosystems. Proc. Natl. Acad. Sci. 104(31): 12942–12947.
[3] Gaston K.J., Tim M. Blackburn & Kees Klein Goldewijk, 2003. Habitat conversion and global avian biodiversity loss. Proc. R. Soc. Lond. B 270, 1293–1300. DOI 10.1098/rspb.2002.2303
[4] Klein Goldewijk, K. 2001 Estimating global land use change over the past 300 years: the HYDE database. Global Biogeochem. Cycles 15, 417–433.
[5] Millennium Ecosystem Assessment (MEA), 2005. Ecosystems and Human Well-being: Synthesis, Island Press, Washington DC.
[6] Teyssèdre A. & D. Couvet, 2007. Expected impact of agriculture expansion on the world avifauna. C. R. Acad. Sci. Biologie 330: 247-254.
[7] GIEC 2019. Climate and land use changes Report.
[8] Couvet D. et al., 2008. Enhancing citizen contributions to biodiversity science and public policy. Interdisciplinary Science Reviews 33 (1) 95-103.
[9] Ellis E.C., 2011. Anthropogenic transformation of the terrestrial biosphere. Phil. Trans. R. Soc. A 369, 1010–1035. doi:10.1098/rsta.2010.0331
[10] Sánchez-Bayo F. & Wyckhuys K.A.G., 2019. Worldwide decline of the entomofauna: A review of its drivers. Biol. Cons. 232: 8–27.
[11] Hallman et al., 2017. More than 75 percent decline over 27 years in total flying insect biomass in protected areas. Plos One 12, e0185809, oct.2017.
[12] Seibold et al., 2019. Arthropod decline in grasslands and forests is associated with landscape-level drivers. Nature 574: 671-674.
[13] van Klink et al., 2020. Meta-analysis reveals declines in terrestrial but increases in freshwater insect abundances. Science 368: 417–420.
[14] Devictor V. et al., 2008. Functional biotic homogenisation of bird communities in disturbed landscapes. Global Ecol. Biogeogr. 17, 252–261.
[15] Clavel J., R. Julliard & V. Devictor, 2011. Worldwide decline of specialist species: toward a global functional homogenization? Front. Ecol. Environ. 9(4): 222–228, doi:10.1890/080216
[16] Le Viol, I. et al. 2012. More and more generalists: two decades of changes in the European avifauna. – Biol. Lett. 8: 780–782.
[17] Hubbell S.P., 2001. The Unified Theory of Biodiversity and Biogeography. Princeton Univ. Press.
[18] Teyssèdre A. & A. Robert, 2014. Contrasted effects of habitat reduction, conversion, and alteration on neutral and non neutral biological communities. Oikos 123: 857–865.
[19] Dornelas M. et al., 2014. Assemblage time series reveal biodiversity change but notsystematic loss. Science 344:296–299.
[20] Teyssèdre A. & A. Robert, 2015. Biodiversity trends are as bad as expected. Biodiversity and Conservation 24 (3): 705-706. DOI 10.1007/s10531-014-0839-7
[21] Bar-On Y.M., R. Phillips & R. Milo, 2018. The biomass distribution on Earth. Proc. Natl. Acad. Sci. 115: 6506-6511.
[22] UICN, 2020. Liste mondiale des espèces menacées
[23] Couvet D. & A. Teyssèdre, 2010. Ecologie et biodiversité, des populations aux socioécosystèmes. Belin, Paris, 340 pp
[24] Hooper D.U. et al., 2005. Effects of biodiversity on ecosystem functioning: A consensus of current knowledge. Ecol. Monogr. Ecological Soc. Am. 75, 3–35; Tilman D., F. Isbell, J. M. Cowles, 2014. Biodiversity and ecosystem functioning. Annu. Rev. Ecol. Evol. Syst. 45: 471–493.
[25] Kéfi S., V. Miele et al., 2016. How structured is the entangled bank? The surprisingly simple organization of multiplex ecological networks leads to increased persistence and resilience. Plos Biology, 3 août 2016. (DOI:10.1371/journal.pbio.1002527)
[26] Cardinale B.J. et al., 2007. Impacts of plant biodiversity on biomass production increase through time because of species complementarity. Proc. Natl. Acad. Sci. 183: 18123-28.
[27] Zhu Y. et al., 2000. Genetic diversity and disease control in rice. Nature 406, 718-722.
[28] Renard D. & D. Tilman, 2019. National food production stabilized by crop diversity. Nature 571, 257-260.
[29] Deguines N., Jono C. et al., 2014. Large-scale trade-off between agricultural intensification and pollination services. Frontiers in Ecology and the Environment, 12, 212-217.
[30] Paredes D., D.S. Karp et al., 2019. Natural habitat increases natural pest control in olive groves: economic implications. Journal of Pest Science
[31] Aubree F., P. David et al., 2020. How community adaptation affects biodiversity-ecosystem functioning relationships. Ecology Letters 23(8): 1263-1275.
[32] Labeyrie V., Antona M. et al., 2021. Networking agrobiodiversity management to foster biodiversity-based agriculture. A review. Agronomy for Sustainable Development, 41, 4.
[33] Steffen W., K. Richardson et al. 2015. Planetary boundaries: Guiding human development on a changing planet. Science 347 (6223) : 736-748.
[34] Voir par exemple les Regards R68, R79, RO6, et autres Regards de la SFE2 sur l’agriculture.
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : TEYSSEDRE Anne (21 novembre 2022), Impacts de l’agriculture sur la biodiversité et le fonctionnement des écosystèmes, Encyclopédie de l’Environnement. Consulté le 27 juillet 2024 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/vivant/impacts-agriculture-biodiversite-fonctionnement-ecosystemes/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.







