L’huître, cette sentinelle témoin d’un littoral à préserver
PDF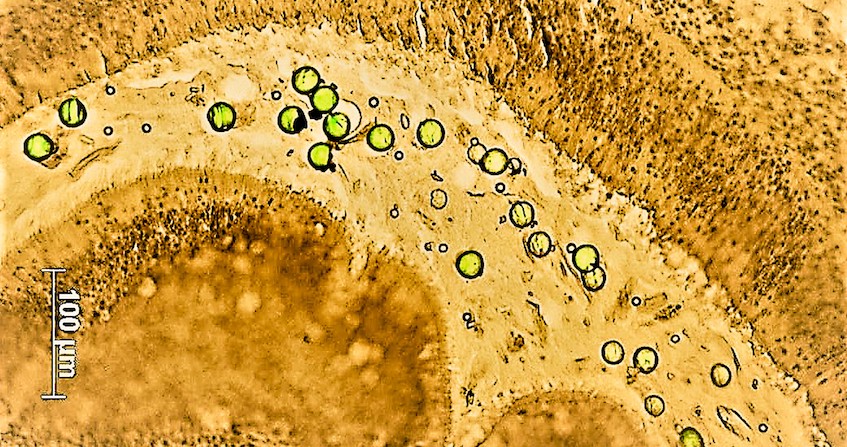
Dans la catégorie des mollusques marins, l’huître est une espèce essentielle de nos côtes françaises et à forts enjeux économique et patrimonial. Espèce ingénieure, elle rend de nombreux services dans les écosystèmes côtiers. Pourtant, les huîtres subissent de fortes pressions dont les pollutions d’origine humaine. Parmi ces pollutions que nous détaillerons dans cet article : les pollutions chimiques, les pollutions biologiques comme les microalgues toxiques naturelles -dont les recrudescences peuvent avoir une origine anthropique-, et de nouveaux contaminants chimiques et particulaires, les microplastiques, complétant ainsi le précédent article montrant l’importance écologique des huîtres et les menaces liées au réchauffement climatique qui pèsent sur elles (Lire Les huîtres : ces architectes méconnus des milieux côtiers). L’huître en tant qu’espèce sentinelle indicatrice de l’état de santé (ou de dégradation) de l’écosystème côtier, se retrouve donc à la place du lanceur d’alerte exigeant des mesures fortes de protection des habitats littoraux.
1. L’huître : un mollusque marin essentiel et menacé

2. Les huîtres victimes de tous les maux
La surexploitation, la destruction d’habitats, et la présence de maladies ou de parasites, pour certains introduits accidentellement par l’activité humaine, constituent de véritables fléaux pour les huîtres (Lire Les huîtres : ces architectes méconnus des milieux côtiers). Des études récentes montrent que les modifications liées à l’urbanisation côtière, au réchauffement climatique et à l’acidification de l’océan pourraient affecter la reproduction des huîtres avec des conséquences pour la filière ostréicole [1]. De plus, les zones côtières au plus proche des activités humaines, rassemblent quantité de polluants comme les pesticides, les résidus médicamenteux, les métaux lourds, les hydrocarbures.
Par exemple, dans le bassin d’Arcachon au début des années 1980, le recrutement (c’est-à-dire l’abondance de jeunes larves fixées d’huître Crassostrea gigas) était devenu inexistant et le renouvellement des stocks naturels s’en trouvait menacé. Ce n’est qu’au bout d’un programme de recherche pluriannuel, que les chercheurs ont mis en évidence la responsabilité du tributylétain [2] présent dans les peintures antifouling [3] dans la mortalité des jeunes larves.
A cette longue liste, il convient d’ajouter les pollutions biologiques faites de bactéries et virus pathogènes, ou encore de micro-algues toxiques.
2.1. Les micro-algues toxiques
Une efflorescence ou bloom de micro-algues marines se définit par la multiplication très rapide de ces organismes unicellulaires photosynthétiques favorisée par les conditions environnementales (Figure 2). Elle est notamment favorisée et amplifiée par l’eutrophisation [4] liée aux rejets des agglomérations et de l’agriculture intensive, connus en Bretagne pour favoriser les marées vertes (Lire Les nitrates dans l’environnement & Phosphore et eutrophisation). Or, parmi les milliers d’espèces de micro-algues, indispensables car à la base de la chaine alimentaire marine et productrices d’une part de l’oxygène que nous respirons, au moins 300 sont connues pour être toxiques lorsqu’elles prolifèrent. On parle alors d’efflorescences algales nuisibles (ou HAB : Harmful Algal Blooms en anglais).
Au cours des dernières décennies, le nombre, l’intensité et la distribution géographique des événements HAB n’ont cessé d’augmenter, en partie à cause du changement global et de l’eutrophisation des zones côtières [3]. Une partie d’entre elles est nuisible du fait de l’effet de masse produit lors des blooms. En effet, des variations extrêmes (température, salinité) lors des canicules de 2018 et 2019 dans la lagune de Thau, ont modifié les communautés planctoniques en favorisant les espèces de très petites tailles peu assimilables par l’huître, ce qui a généré un phénomène d’eau verte. Le responsable était un bloom de Picochlorum, un phytoplancton de quelques micromètres tolérant ces grandes variations environnementales mais sans intérêt alimentaire pour l’huître. Ces micro-algues étouffent alors littéralement l’environnement où elles prolifèrent. Cela peut entrainer par exemple des occlusions des branchies chez les animaux filtreurs ou encore priver d’oxygène les espèces environnantes et entrainer des mortalités massives par anoxie.
Il y a, de plus, une centaine de micro-algues toxiques qui produisent des phycotoxines. Certaines présentent un danger pour la santé humaine par leur accumulation dans les organismes marins consommés par l’Homme. Plusieurs types de toxines sont répertoriés et classées en fonction des syndromes qu’elles engendrent chez l’Homme, dont les PSP (paralysantes), les DSP (diarrhéiques), les ASP (amnésiantes), les NSP (neurotoxiques), les CFP (Ciguatera).

En France, des efflorescences de micro-algues productrices de toxines paralysantes, en particulier des dinoflagellés Alexandrium minutum et Alexandrium catenella, sont régulièrement enregistrées depuis les années 1980 :
- En Rade de Brest, plusieurs efflorescences d’A. minutum ont eu lieu depuis l’été 2012 alors qu’elles n’avaient jamais été enregistrées auparavant [1].
- En juillet 2012, cette concentration d’A. minutum a même atteint des taux records provoquant la fermeture de la vente de coquillages qui dépassaient de 10 fois le seuil sanitaire toxinique.
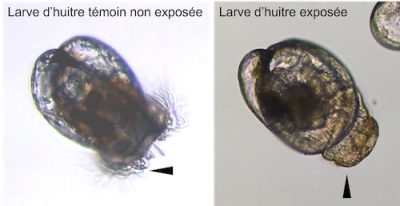
Récemment, il a été découvert que les huîtres ne seraient pas si sensibles aux toxines paralysantes, contrairement aux mammifères, mais qu’elles le seraient beaucoup plus à des substances excrétées par Alexandrium minutum et qui expliqueraient la plupart des symptômes observés chez les huîtres. Il est urgent d’identifier la nature chimique de ces nouveaux composés.
2.2. Les pollutions chimiques
L’huître est utilisée comme sentinelle de la contamination environnementale dans le cadre du réseau d’observation de la contamination chimique (ROCCH) opéré par l’Institut Français de Recherche pour l’Exploitation de la Mer (Ifremer). Comme la moule et d’autres organismes, ce mollusque a la propriété de concentrer certains polluants chimiques présents dans son environnement de manière proportionnelle à son exposition. Depuis 1974, dans le cadre du ROCCH, des métaux tels que le cadmium, le cuivre, le mercure ou le plomb, des hydrocarbures aromatiques polycycliques (HAP), des polychlorobiphényles (PCB), des polybromodiphényléthers (PBDE) et certains pesticides comme le lindane, l’aldrine et des résidus de DDT sont analysés, une fois par an, dans la chair des huîtres pour renseigner sur la qualité du milieu marin.
Cette démarche n’est pas propre à la France et dans de nombreux pays du monde, des huîtres sont utilisées pour évaluer la contamination chimique de l’environnement soit dans le cadre de réseaux de surveillance pérennes soit lors d’études scientifiques ponctuelles. Ces dernières permettent la recherche de polluants émergents à l’image d’une récente étude menée sur les côtes portugaises dans laquelle, en plus des polluants précédemment décrits, 29 retardateurs de flamme, 35 pesticides (dont des insecticides pyréthrinoïdes) et 13 produits de soin (tels que des muscs et des filtres UV) ont été mesurés [8].
Au-delà de son rôle d’espèce sentinelle, l’huître est également une espèce modèle en toxicologie environnementale, discipline qui étudie les effets des polluants sur les organismes :
- Des expositions de courte durée aux produits phytopharmaceutiques (à des concentrations semblables à celles retrouvées dans le milieu marin) altèrent la structure de leur ADN et les processus de réparation de cet ADN. Ces effets peuvent atteindre les cellules germinales et se propager à la descendance [9].
- Les pesticides affectent aussi les défenses immunitaires de l’huître et son métabolisme, notamment énergétique [10].
- Enfin, les métaux lourds, les HAP ou encore certains médicaments ont la capacité à altérer la physiologie de l’huître ; les effets non intentionnels de ces molécules étant alors intimement liés à leur mécanisme d’action. Il a par exemple été démontré que les antidépresseurs ont la capacité à perturber le développement embryonnaire des huîtres (on parle d’embryotoxicité) jusqu’à la métamorphose des larves [11].
La validité de ces résultats de laboratoire doit maintenant être évaluée dans les conditions plus complexes du milieu naturel. Des travaux menés sur des organismes prélevés directement dans le milieu naturel permettent de faire le lien entre la contamination de l’environnement, la bioaccumulation des polluants dans les tissus et l’état de santé des organismes. Une étude indienne, réalisée sur plusieurs sites de la côte de la mer d’Arabie, caractérisés par une contamination par des HAP et des métaux lourds, a mis en lumière une corrélation entre la bioaccumulation de différents HAP et des atteintes de l’intégrité de l’ADN chez les huîtres Saccostrea cucullata ; atteintes dont on connait désormais la capacité à perturber, chez l’huître, la descendance des organismes exposés [12]. Ces résultats posent alors invariablement la question de la répercussion des effets individuels observés sur les populations et plus largement les écosystèmes : un champ de recherche qui reste à ce jour largement inexploré…
2.3. De nouveaux contaminants particulaires : les microplastiques

En moyenne, 80% des débris plastiques retrouvés en mer proviennent de la terre (vent, fleuves, lessivages, eaux usées) et le reste des activités maritimes (tourisme, nautisme, pêche, aquaculture). Les impacts des plastiques en mer peuvent être présentés en deux grands volets.

La deuxième grande catégorie d’impacts des déchets plastiques en mer n’est visible que sur les grands animaux marins (oiseaux, mammifères ou tortues) piégés dans des déchets plastiques ou leur obstruant les voies respiratoires ou digestives. Pourtant, ce n’est que la partie visible de l’iceberg puisque plus de 90% des déchets plastiques en mer sont des microplastiques de taille inférieure à 5 mm (Figure 5). De par leur petite taille, ces microplastiques sont facilement ingérés le long de la chaine alimentaire. Les premiers à y être confrontés sont les organismes filtreurs dont font partie les huîtres.
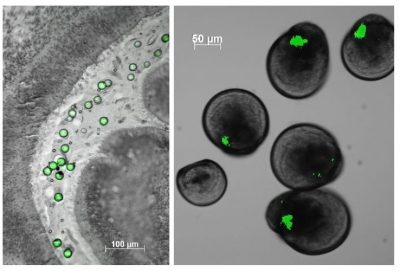
Quant aux plus petits débris, les nanoplastiques dont on ignore encore les quantités en mer faute de méthodes innovantes, leur petite taille leur permet d’interagir avec les membranes biologiques. L’huître ayant une fécondation externe, ses gamètes une fois émis dans la mer sont confrontés aux aléas environnementaux. Alors que des micro-billes de polystyrène sont sans effet (dans nos conditions d’expérience) sur les gamètes, embryons et larves d’huître, les nano-billes de 50 nanomètres les perturbent fortement. Comment nous direz-vous ?

- Des nanoplastiques ont été observés par microscopie électronique collés à la surface des spermatozoïdes d’huîtres (Figure 7) ce qui empêcherait leur mobilité nécessaire à leur pouvoir fécondant [14].
- Exposés pendant 24 heures à ces nano-billes, des embryons d’huîtres présentent des malformations jusqu’à des arrêts complets de leur développement à forte dose [15].
Enfin, l’alimentation des huîtres, et plus largement des bivalves, n’est pas épargnée puisque le cycle de vie de micro-algues diatomées est apparu également perturbé par ces nanoplastiques montrant l’importance de comprendre les effets des micro- et nano-plastiques à l’échelle complexe des écosystèmes.
3. Que faire ? Existe-t-il des solutions ?
Nombre de solutions existent ou sont à découvrir pour remédier aux principales pressions anthropiques. Nous pouvons citer l’exemple du tributylétain dont l’interdiction a été décidée en France dès 1982, puis généralisée au niveau mondial en 2001 en raison de sa toxicité avérée et des risques environnementaux. Toutefois, trouver des alternatives au tributylétain, biocides et non toxiques (ce qui est a priori contradictoire), donc sans risque pour l’environnement, s’avère être un enjeu complexe nécessitant de la recherche et de l’innovation technologique de premier plan. Et ce raisonnement s’amplifie et se complexifie en considérant la diversité des pollutions, de leurs sources et usages. Aucune solution ne pourra, à elle seule, régler les problèmes.
Les actions scientifiques de suivi et de recherche sont nécessaires à la compréhension des pollutions et de leurs effets dans la nature, et tout autant pour la sensibilisation du grand public et des décideurs. Elles sont notamment encadrées au niveau européen dans la Directive Cadre « Stratégie pour le Milieu Marin » (DCSMM) [16] dont l’objectif est l’obtention d’un « bon état écologique » des eaux marines européennes à l’horizon 2020, horizon prolongé dans les années à venir.
Une juxtaposition de solutions le long de l’ensemble de la chaîne de valeur, est et sera donc nécessaire pour limiter et endiguer les pollutions à la source. Cela passe par :
- La sobriété dès l’extraction des matières premières et la production jusqu’aux usages (par exemple pour les plastiques, voir le rapport parlementaire [17]), et donc des modifications de nos comportements industriels, agricoles, citoyens ;
- Une bien meilleure gestion de la fin de vie des produits et déchets ;
- Des développements technologiques industriels notamment pour de nouveaux procédés, produits, matériaux tels que biosourcés, et/ou biodégradables, en tout état de cause non impactant pour l’environnement et la santé humaine;
- La législation notamment celle du droit de l’environnement pour l’élaboration de règles juridiques visant à la protection de l’environnement. Protéger nos zones marines côtières si précieuses, est une voie à renforcer pour garder l’intégrité du système Océan, bien commun de l’Humanité.
4. Messages à retenir
- De nombreux polluants, pesticides, résidus médicamenteux, métaux lourds, microplastiques, ont des effets sur l’ensemble du cycle de vie de l’huître.
- Certains effets toxiques peuvent se propager à la génération suivante de jeunes huîtres (embryotoxicité, perturbation endocrine).
- L’effet « cocktail» de ces polluants reste à étudier pour la compréhension de l’évolution des populations d’huîtres.
- Les huîtres, présentes sur nos côtes depuis des millions d’années, se retrouvent lanceurs d’alerte exigeant des mesures fortes de protection des habitats littoraux.
Notes et références
Image de couverture. Détection de microsphères en polystyrène fluorescentes dans le tractus digestif d’une huître après une exposition expérimentale [Source : © IFREMER]
[1] Thomas, Y. (2018). Oysters as sentinels of climate variability and climate change in coastal ecosystems. Environmental Research Letters 13, 104009. Publisher’s official version : https://doi.org/10.1088/1748-9326/aae254 , Open Access version : https://archimer.ifremer.fr/doc/00461/57255/
[2] https://perturbateursendocrinienssite.wordpress.com/2017/05/04/tributyletain/
[3] https://fr.wikipedia.org/wiki/Antifouling
[4] Chapelle, A. (2016). Modélisation du phytoplancton dans les écosystèmes côtiers. Application à l’eutrophisation et aux proliférations d’algues toxiques. https://archimer.ifremer.fr/doc/00360/47141/
[5] https://wwz.ifremer.fr/envlit/Surveillance-du-littoral/Phytoplancton-et-phycotoxines
[6] Payton, L. (2017). Chronobiologie moléculaire et comportementale des huîtres Crassostrea gigas diploïdes et triploïdes exposées à l’algue toxique Alexandrium minutum. Thèse de l’Université de Bordeaux. https://tel.archives-ouvertes.fr/tel-01579783/document
[7] Castrec, J (2018). Impacts des efflorescences du dinoflagellé toxique Alexandrium minutum sur la reproduction et le développement de l’huître Crassostrea gigas. Thèse de l’Université de Bretagne occidentale. https://tel.archives-ouvertes.fr/tel-03035012/document
[8] Gadelha, J.R. (2019). Persistent and emerging pollutants assessment on aquaculture oysters (Crassostrea gigas) from NW Portuguese coast. Science of the Total Environment, 666, 731-742.
[9] Bachere, E. (2017). Parental diuron-exposure alters offspring transcriptome and fitness in Pacific oyster Crassostrea gigas. Ecotoxicology and Environmental Safety, 142, 51-58. https://doi.org/10.1016/j.ecoenv.2017.03.030
[10] Epelboin, Y. (2015). Energy and Antioxidant Responses of Pacific Oyster Exposed to Trace Levels of Pesticides. Chemical Research In Toxicology, 28, 1831-1841. Publisher’s official version : https://doi.org/10.1021/acs.chemrestox.5b00269 , Open Access version : https://archimer.ifremer.fr/doc/00284/39490/
[11] Di Poi, C. (2014). Toxicity of five antidepressant drugs on embryo-larval development and metamorphosis success in the Pacific oyster, Crassostrea gigas. Environmental Science and Pollution Research, 21, 13302-13314.
[12] Melwani, A.R. (2016). PAHs and heavy metals at each sampling location along the west coast of India around Goa, India. Aquatic Toxicology, 173, 53-62.
[13] Sussarellu, R. (2016). Oyster reproduction is affected by exposure to polystyrene microplastics. Proc. Natl. Acad. Sci. USA, 113, 2430-2435. Open Access version : https://archimer.ifremer.fr/doc/00311/42233/
[14] Tallec, K. (2019). Impacts des nanoplastiques et microplastiques sur les premiers stades de vie (gamètes, embryons, larves) de l’huître creuse Crassostrea gigas. Thèse de l’Université de Bretagne occidentale. https://tel.archives-ouvertes.fr/tel-02996550/document
[15] Green, D.S. (2017). Microplastics affect the ecological functioning of an important biogenic habitat. Environmental Sciences Technology, 51, 68-77.
[16] Directive Cadre Stratégie pour le Milieu Marin « Comment garder ou retrouver des mers et océans en bonne santé ? » https://wwz.ifremer.fr/Expertise/Eau-Biodiversite/Directive-Cadre-Strategie-pour-le-Milieu-Marin
[17] Rapport parlementaire « Pollution plastique : une bombe à retardement ? » http://www.senat.fr/rap/r20-217/r20-2171.pdf
L’Encyclopédie de l’environnement est publiée par l’Association des Encyclopédies de l’Environnement et de l’Énergie (www.a3e.fr), contractuellement liée à l’université Grenoble Alpes et à Grenoble INP, et parrainée par l’Académie des sciences.
Pour citer cet article : HUVET Arnaud, SANCHEZ Wilfried, POUVREAU Stéphane, FABIOUX Caroline (15 septembre 2021), L’huître, cette sentinelle témoin d’un littoral à préserver, Encyclopédie de l’Environnement. Consulté le 26 avril 2024 [en ligne ISSN 2555-0950] url : https://www.encyclopedie-environnement.org/vivant/huitre-temoin-littoral-a-preserver/.
Les articles de l’Encyclopédie de l'environnement sont mis à disposition selon les termes de la licence Creative Commons BY-NC-SA qui autorise la reproduction sous réserve de : citer la source, ne pas en faire une utilisation commerciale, partager des conditions initiales à l’identique, reproduire à chaque réutilisation ou distribution la mention de cette licence Creative Commons BY-NC-SA.







